

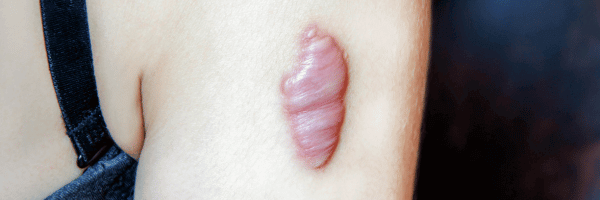
Cicatrice hypertrophique et chéloïde : diagnostic prévention et traitement
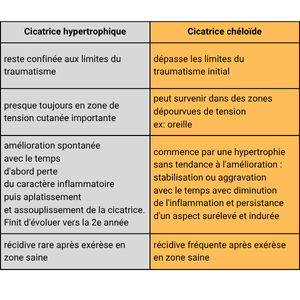
Les cicatrices hypertrophiques et les cicatrices chéloïdes représentent deux formes de cicatrisation pathologique fréquemment rencontrées après chirurgie ou traumatisme cutané. Elles partagent un mécanisme commun d’hyperprolifération fibroblastique, mais se distinguent par leur évolution clinique : la cicatrice hypertrophique reste confinée aux berges de la plaie et tend à régresser, tandis que la cicatrice chéloïde envahit les tissus sains voisins, formant une masse fibreuse persistante.
La prise en charge thérapeutique repose sur une prévention précoce (silicone, pressothérapie, hydratation) et, en cas d’évolution défavorable, sur des traitements curatifs combinés : injections de corticoïdes intralésionnelles, laser, voire chirurgie associée à une radiothérapie. L’objectif est d’obtenir une cicatrice plane, souple et indolore, tout en limitant le risque de récidive.
Sommaire
- Quelle est la différence entre cicatrice hypertrophique et cicatrice chéloïde ?
- Quelles sont les caractéristiques cliniques et histologiques d’une cicatrice hypertrophique ?
- Quelles sont les particularités de la cicatrice chéloïde ?
- Quels sont les facteurs de risque des cicatrices hypertrophiques et chéloïdes ?
- Quels traitements préventifs permettent d’éviter ces cicatrices ?
- Quels traitements curatifs peut-on proposer après six mois ?
- Quel est l’intérêt du traitement par laser ?
- Quand envisager la chirurgie et la radiothérapie ?
- Quels traitements ont démontré leur efficacité scientifique ?
- Sources
Quelle est la différence entre cicatrice hypertrophique et cicatrice chéloïde ?
Les cicatrices hypertrophiques et chéloïdes partagent une hyperprolifération dermique. La précocité du traitement chirurgical associé à la prévention secondaire a permis de réduire ces séquelles cutanées. C’est l’évolution qui va distinguer ces deux types de cicatrices.
Quelles sont les caractéristiques cliniques et histologiques d’une cicatrice hypertrophique ?
La cicatrice hypertrophique se manifeste par une lésion boursouflée, rouge, douloureuse et prurigineuse. Elle apparaît dans le mois suivant le traumatisme et reste confinée dans les limites de la plaie initiale, souvent dans les zones de tension cutanée.
Histologiquement, elle contient des myofibroblastes et du collagène de type III orienté parallèlement au derme. Elle tend à régresser spontanément après 12 à 18 mois. La récidive après exérèse chirurgicale reste rare.
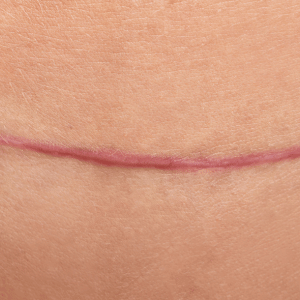
Quelles sont les particularités de la cicatrice chéloïde ?
La cicatrice chéloïde débute comme une cicatrice hypertrophique mais évolue différemment. C’est une forme invasive et persistante. Elle est rare chez le brûlé.
En quoi la cicatrice chéloïde diffère-t-elle fondamentalement de la cicatrice hypertrophique ?
Elle envahit la peau saine et s’étend au-delà de la plaie initiale, formant des prolongements irréguliers parfois en « pinces d’écrevisse ». Elle apparaît même dans des zones sans tension (ex. : oreille).
Histologiquement, ses fibres de collagène sont plus épaisses et désorganisées, sans myofibroblastes, ce qui explique la fréquence des récidives après exérèse.
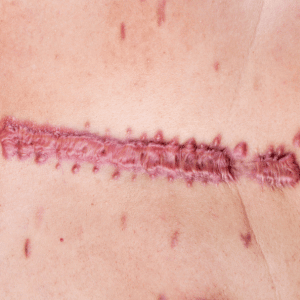
Quels sont les facteurs de risque des cicatrices hypertrophiques et chéloïdes ?
- Facteurs ethniques et génétiques : prévalence élevée chez les peaux noires et asiatiques.
- Âge : risque accru entre 10 et 30 ans.
- Localisation : sternum, épaules, cou, oreilles, visage, pubis, genou.
- Autres facteurs : infection, corps étranger, « peau grasse » (séborrhéique).
Quels traitements préventifs permettent d’éviter ces cicatrices ?
Pourquoi la prévention est-elle essentielle ?
La prévention débute dès la cicatrisation complète et se poursuit 6 semaines à 24 mois selon le contexte.
Le massage cicatriciel est-il efficace ?
Le massage cicatriciel (palper-rouler) favorise la souplesse et la revascularisation. Il débute trois semaines après le retrait des points.
Les pansements siliconés sont-ils un traitement clé ?
Les pansements siliconés (MEPIFORM®, CICA CARE®, LUMIDERM®…) sont le traitement de référence. Application progressive (2h/j → 16h/j), lavables et réutilisables. Pour les zones difficiles : gels de silicone (Cicaplast B5®, KELO-COTE®).
Quel est le rôle de la pressothérapie ?
Les vêtements compressifs (JOBST®, THUASNE®…) exercent une pression de 6 à 13,5 mmHg, réduisant œdème et tension cicatricielle.
Pourquoi l’hydratation cutanée est-elle importante ?
L’hydratation entretient la souplesse cutanée. Le gel de silicone s’applique matin et soir sur peau propre et sèche.
Existe-t-il d’autres traitements préventifs ?
La mécano-stimulation (LPG®) peut être proposée sur cicatrice mature et solide.

Quels traitements curatifs peut-on proposer après six mois ?
Quel est l’intérêt de la corticothérapie intralésionnelle ?
Les injections de triamcinolone acétonide (Kenacort®) réduisent l’inflammation, le prurit et l’épaisseur de la cicatrice. Applications topiques limitées pour éviter l’atrophie.
Quels sont les autres traitements injectables disponibles ?
- 5-Fluorouracile (5-FU) : aplatit les cicatrices et améliore les symptômes.
- Bléomycine : effet durable avec bonne tolérance.
Quel est l’intérêt du traitement par laser ?
Les lasers vasculaires (à colorant pulsé) ou fractionnés (CO₂, Er:YAG) réduisent la vascularisation et améliorent texture et souplesse. Le PDL est considéré comme le « gold standard ».
Quand envisager la chirurgie et la radiothérapie ?
Après un an sans amélioration, une révision chirurgicale peut être envisagée, associée à une brachythérapie post-opératoire à l’iridium 192 (4–5 fractions de 3 Gy).
Pour les lésions étendues : derme artificiel Integra® et greffe secondaire pour guider la cicatrisation.
Quels traitements ont démontré leur efficacité scientifique ?
- Pressothérapie (plaques ou gels de silicone)
- Injections de corticoïdes intralésionnels
- Correction chirurgicale ciblée
La prise en charge reste individualisée et multidisciplinaire, impliquant chirurgiens, dermatologues et radiothérapeutes.
Sources et références
- Prise en charge non chirurgicale des cicatrices hypertrophiques et chéloïdes (2018)
- Management of keloid and hypertrophic scars (2005)
- Le traitement médical des cicatrices hypertrophiques et chéloïdes (2018)
- Traitement des chéloïdes : où en sommes-nous ? Revue Médicale Suisse (2019)
- Management of Keloids and Hypertrophic Scars, American Family Physician (2024)
- Management of Keloids and Hypertrophic Scars (2009)
- Strategies to prevent hypertrophic scar formation: a review (2020)
- The Most Current Algorithms for the Treatment and Prevention of Hypertrophic Scars and Keloids, Plastic and Reconstructive Surgery (2021)
- Silicone sheets and new gels to treat hypertrophic scars and keloids: A short review (2020)
- The use of fluid silicone gels in the prevention and management of scars (2022)
- Topical Silicone Sheet Application in the Treatment of Hypertrophic Scars and Keloids (2016)
- Prevention and management of hypertrophic scars after laparoscopic surgery using silicone gel sheets (2022)
- An International e-Delphi Study on the Treatment of Keloids with Intralesional Corticosteroids (2024)
- Combined versus single treatment regimens for keloid therapy (2021)
- Treatment of hypertrophic scars and keloids using intralesional laser therapy (2020)
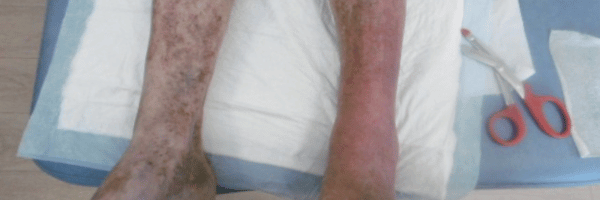
Dermite ocre : définition, symptômes, traitement et prévention de cette complication de l’insuffisance veineuse
Définition de la dermite ocre
La dermite ocre correspond à une hyperpigmentation brun-rouille des jambes secondaire à l’hyperpression veineuse chronique. Il s’agit d’un signe clinique de dermatite de stase (ou dermite de stase) et non d’une entité autonome. Dans la classification CEAP 2020 (classification internationale des maladies veineuses chroniques), elle relève du stade C4a (pigmentation et/ou eczéma) ; C4b = lipodermatosclérose/atrophie blanche, C4c = corona phlebectatica ; C6 = ulcère veineux actif.
Codage CIM-10 dermite ocre : Le codage le plus utilisé pour la dermite de stase/dermite ocre dans le contexte d’insuffisance veineuse est I87.2 – Insuffisance veineuse (chronique) (périphérique). Des codes I83.x s’ajoutent en cas de varices avec ulcère/inflammation.
Clinique et symptômes
Le diagnostic est clinique, dans un contexte d’insuffisance veineuse chronique connue ou suspectée. Les signes incluent : macules ou nappes brun-rouille péri-malléolaires, parfois confluentes avec extension ascendante ; prurit ou sensation de chaleur, parfois décrit par les patients comme des jambes qui grattent ; association possible à œdème, varicosités, ou eczéma de stase. Des descriptions fréquentes sont l’apparition de taches sur les jambes, parfois évoluant en tache rouge sur les jambes, ou en tache brune pied cheville et plaque rouge cheville en cas d’eczéma cheville associé.
Un écho-Doppler veineux est recommandé pour documenter le reflux ou l’obstruction.
Physiopathologie de la dermite ocre
L’hypertension veineuse entraîne l’extravasation des globules rouges hors des capillaires. Le fer contenu dans l’hémoglobine se dépose sous forme d’hémosidérine dans le derme, ce qui déclenche une réaction inflammatoire locale (stress oxydant, MMP) pouvant entraîner une fibrose dermo-hypodermique responsable de la lipodermatosclérose, de l’atrophie blanche et parfois d’angiodermite.
Causes principales
- Insuffisance veineuse chronique superficielle (reflux saphénien, perforantes) ou profonde (post-thrombotique, obstruction).
- Hyperpression fonctionnelle prolongée : station debout prolongée, obésité, multiparité, antécédents chirurgicaux/traumatiques veineux (en particulier hanche, genou, cheville).
Facteurs de risque
Âge avancé, surcharge pondérale, sédentarité, professions en orthostatisme, antécédents de TVP/TVS, prédisposition familiale, mobilité de cheville diminuée.
Diagnostics différentiels
- Eczéma de stase (C4a) : plaques érythémato-squameuses très prurigineuses.
- Dermatoses purpuriques pigmentées (maladie de Schamberg).
- Hyperpigmentation post-inflammatoire.
- Hémosidérose post-traumatique (sidérose iatrogène).
- Hémochromatose (pigmentation diffuse non localisée aux jambes).
- Vascularites (purpura palpable, nécroses).
Complications et évolution
La dermite ocre est un marqueur de gravité de l’insuffisance veineuse chronique. Elle augmente le risque d’ulcère veineux (C6), parfois décrit comme une plaie variqueuse. Le prurit est fréquent, les douleurs surviennent surtout en cas de sclérose cutanée ou d’ulcération. Des surinfections cutanées, des dermatites de contact et un œdème de stase peuvent compliquer l’évolution. Le pronostic dépend du traitement veineux et de l’adhésion à la compression.
Principes du traitement
1) Traitement veineux
- Compression médicale : bas, chaussettes ou bandages (20–40 mmHg). Toujours vérifier l’absence d’artériopathie par la mesure de l’IPS.
- Interventions veineuses : sclérothérapie, ablation thermique endoveineuse, MOCA, cyanoacrylate, chirurgie. Chez l’ulcéreux, l’ablation précoce du reflux accélère la cicatrisation.
2) Prise en charge cutanée
- Émollients quotidiens pour réparer la barrière cutanée.
- Dermocorticoïdes en cas d’eczéma de stase ou d’eczéma cheville.
- Antiseptiques dermite ocre / antibiotiques locaux uniquement si lésions érodées/surinfectées.
- Dépigmentants/chélateurs de fer : efficacité limitée.
- Topiques cuivre-zinc ou crème dermite ocre : effets prometteurs mais non confirmés.
- Lasers/photothérapie (Nd:YAG, alexandrite, IPL) : options expérimentales.
3) Mesures associées
Protection cutanée, hydratation, élévation des jambes, éviter le piétinement et l’orthostatisme prolongé, marche quotidienne et exercices de pompe du mollet, contrôle pondéral. Des approches alternatives comme certains « remèdes de grand-mère » pour la dermite ocre sont parfois évoquées mais ne sont pas validées scientifiquement.
Prévention et suivi
La prévention repose sur la compression au long cours, le suivi coordonné (médecin traitant, angiologue, infirmier, dermatologue si besoin). L’éducation du patient est essentielle pour la prévention de l’ulcère veineux, parfois confondu avec une plaie variqueuse montrant des lésions cutanées avancées.
Éducation thérapeutique (ETP)
L’adhésion à la contention est primordiale. Hygiène cutanée simple avec émollients, auto-surveillance des signes d’aggravation, activité physique régulière, gestion du poids.
Points clés à retenir
- La dermite ocre correspond au stade C4a de la classification CEAP.
- C’est un facteur de risque d’ulcère veineux et un marqueur de sévérité de l’IVC.
- La compression veineuse et le traitement étiologique sont essentiels.
- Les lasers et traitements dépigmentants restent expérimentaux.
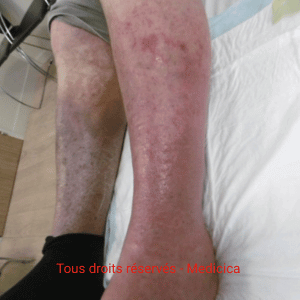
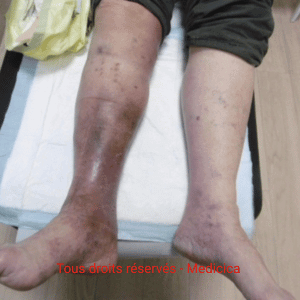
FAQ Dermite ocre
Qu’est-ce que la dermite ocre ? (définition générale + « dermite ocre des jambes »)
La dermite ocre des jambes est une hyperpigmentation brun-rouille secondaire à l’hyperpression veineuse chronique. Elle reflète la sévérité de l’insuffisance veineuse et correspond au stade C4a de la classification CEAP.
Quels sont les signes cliniques précoces et évolutifs ?
Coloration brun-rouille péri-malléolaire s’étendant parfois à la jambe, jambes qui grattent, taches sur les jambes, ou plaque rouge cheville en cas d’eczéma associé ; la douleur est rare hors sclérose ou ulcère.
Comment différencier la dermite ocre, de l’eczéma de stase, l’hémosidérose, l’hyperpigmentation post-inflammatoire, l’hémochromatose, et le purpura ?
Dermite ocre : pigmentation ferrique liée à l’IVC. Eczéma de stase : prurit marqué et plaques inflammatoires. Hémosidérose post-traumatique : localisée. Hyperpigmentation post-inflammatoire : après dermatose. Hémochromatose : diffuse. Vascularites : purpura palpable.
Quel est le Code CIM-10 correspondant à la dermite ocre ?
I87.2 – Insuffisance veineuse (chronique) (périphérique), avec éventuellement I83.x en cas de varices compliquées.
Quelles sont les causes principales ?
IVC superficielle ou profonde, hyperpression prolongée (station debout, obésité, grossesses multiples).
Quel le mécanisme de dépôt d’hémosidérine, le rôle du fer et de l’inflammation ?
L’extravasation des hématies entraîne un dépôt d’hémosidérine riche en fer, déclenchant une inflammation et une fibrose locale.
Quels sont les facteurs de risque ?
Âge, obésité, sédentarité, antécédents de TVP/TVS et orthostatisme prolongé.
Quelle est la physiopathologie (microcirculation, inflammation chronique) ?
Hyperpression veineuse, altérations microcirculatoires, inflammation chronique conduisant à la lipodermatosclérose et à l’atrophie blanche.
Comment diagnostiquer en pratique clinique ?
Diagnostic clinique : pigmentation brun‑rouille péri‑malléolaire dans un contexte d’IVC.
Quels sont les examens utiles ?
Écho‑Doppler veineux pour objectiver le reflux et évaluer la sévérité ; bilan vasculaire selon contexte.
Scores ou protocoles standardisés éventuels ?
La classification CEAP est la référence pour stadifier la maladie veineuse chronique. La compression est le traitement principal.
Quels sont les diagnostics différentiels avec d’autres dermatoses pigmentées ?
À distinguer de l’eczéma de stase, de l’hémosidérose post‑traumatique, de l’hyperpigmentation post‑inflammatoire, de l’hémochromatose et des vascularites.
La dermite ocre est-elle grave ?
Pas grave en soi, mais marqueur de sévérité et facteur de risque d’ulcère.
La dermite ocre démange-t-elle ? Est-elle douloureuse ?
Prurit fréquent ; douleur rare hors sclérose ou ulcère.
Quels sont les risques d’évolution ?
Risque d’ulcère veineux, d’atrophie blanche, de lipodermatosclérose et de surinfections.
Quelles sont les urgences cliniques possibles ?
Plaie variqueuse infectée ou dermite de stase surinfectée : prise en charge rapide.
Quel est le Pronostic à long terme
Dépend du contrôle étiologique veineux et de l’adhésion à la compression.
Quelle est l’approche thérapeutique standard ?
Compression médicale + prise en charge étiologique veineuse.
Quel est le rôle de la compression élastique (types de dispositifs, indications) ?
Bas, chaussettes, bandes (20–40 mmHg) en première intention, après vérification de l’IPS.
Quels sont les traitements topiques possibles ?
Émollients, dermocorticoïdes en cas d’eczéma ; topiques cuivre‑zinc, dépigmentants/chélateurs de fer (efficacité limitée) ; antiseptiques uniquement en cas de surinfection.
Quelles sont les options de médecine interventionnelle ?
Sclérothérapie, ablation thermique, MOCA, cyanoacrylate, chirurgie selon indication (notamment en contexte d’ulcère).
Quelles innovations thérapeutiques ?
Lasers dépigmentants et photothérapie : options encore évaluées, données limitées.
Quelles sont les mesures complémentaires ?
Hydratation, élévation des jambes, activité physique, perte de poids, cures thermales.
Comment prévenir la progression vers l’ulcère ?
Compression, hygiène de vie, suivi régulier.
Quelles sont les mesures pour éviter la récidive ?
Compression quotidienne, contrôle pondéral, activité physique.
Quelle éducation du patient ?
Adhésion au port de compression, hygiène cutanée, auto‑surveillance.
Quel suivi à long terme ?
Suivi régulier par médecin, infirmier, angiologue et dermatologue si besoin.
Quand orienter vers un angiologue, dermatologue, phlébologue ?
En cas de doute diagnostique, d’ulcère ou de complications cutanées.
Coordination médecin généraliste – infirmier(ère) – spécialiste ?
Coordination indispensable pour la pose de la compression, le suivi cutané et la prise en charge globale.
Importance de l’éducation thérapeutique et du parcours de soins pluridisciplinaire ?
L’ETP est essentielle pour prévenir les ulcères et améliorer l’observance thérapeutique.
Références
- Lurie F, et al. The 2020 update of the CEAP classification system. J Vasc Surg Venous Lymphat Disord. 2020.
- Zegarra TI, et al. CEAP Classification of Venous Disorders. StatPearls. 2023.
- Yosipovitch G, et al. Stasis Dermatitis: Clinical presentation & management. Dermatol Ther (Heidelb). 2023.
- Attaran RR, et al. Chronic venous disease—skin changes. JSCAI. 2023.
- WHO ICD-10 CM. I87.2 – Venous insufficiency (chronic) (peripheral). 2025.
- EWMA. Compression therapy – Guidelines. 2023.
- Bernatchez SF, et al. Venous leg ulcers: assessment & compression. Wound Rep Reg. 2021.
- Gohel MS, et al. Early endovenous ablation in venous ulcers (EVRA). N Engl J Med. 2018.
- Heidemeyer K, et al. QS‑Nd:YAG lasers in cutaneous siderosis. Acta Derm Venereol. 2020.
- MSD Manual Professional Edition. Stasis dermatitis. 2025.
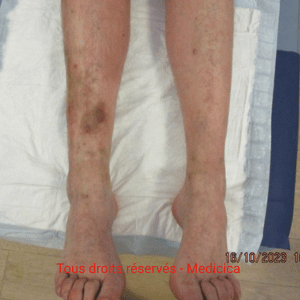
Dermite de stase : définition, diagnostic et prise en charge
La dermite de stase ou dermatite de stase (eczéma variqueux) est une complication cutanée fréquente de l’insuffisance veineuse chronique.
Elle associe eczéma prurigineux, hyperpigmentation par hémosidérine (souvent perçue comme des taches sur les jambes liées à la circulation),
œdème vespéral et risque évolutif vers l’ulcère veineux. La reconnaissance précoce et une prise en charge adaptée — notamment la
compression veineuse — préviennent les complications.
Physiopathologie
Hypertension veineuse chronique
Pression veineuse ambulatoire élevée sur insuffisance veineuse superficielle ou profonde (reflux valvulaire/obstruction)→ activation endothéliale, extravasation d’hématies, inflammation locale ;
terrain propice aux plaques rouges (érythème) péri-malléolaires et au développement de plaie variqueuse.
Inflammation et microangiopathie cutanée
Recrutement leucocytaire, perméabilité capillaire, dépôts d’hémosidérine auto-entretenant l’inflammation, spongiose, fibrose dermique, excès de MMP →
altération de la cicatrisation et ulcération.
Causes et facteurs de risque
Âge (progressif dès ~30 ans), sexe féminin (~3:1), multiparité/hormones, varices (C2+), syndrome post-thrombotique/TVP,
obésité, sédentarité, station debout prolongée, chaleur. Insuffisance cardiaque droite et HTA possibles.
Les antécédents d’ulcère ou de dermite ocre témoignent d’une stase installée.
Diagnostic clinique
Présentation et topographie
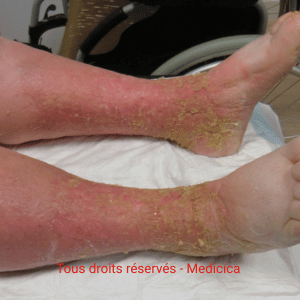
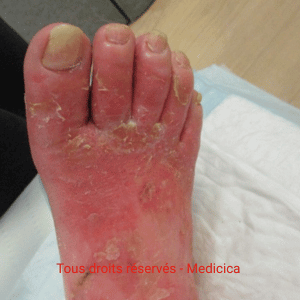
Eczéma chronique prurigineux des jambes : plaques rouges à la cheville mal délimitées, squameuses, xérose (sécheresse cutanée), dermite ocre.
Topographie péri-malléolaire interne ± dos du pied ; parfois extension vers la cuisse avec eczéma cheville /
eczéma variqueux jambes.
Signes associés : télangiectasies malléolaires, lipodermatosclérose (jambe “bouteille de champagne inversée”),
varices, œdème vespéral à godet. Le prurit des tibias/mollets est fréquent (requête “démangeaisons tibias mollets”).
Formes évolutives
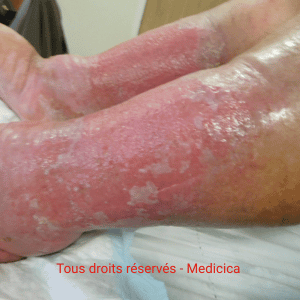
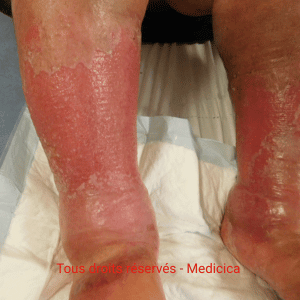
- Aiguë : poussées érythémato-suintantes (vésicules/bulles), confusion possible avec dermite de contact ; contexte de jambe rouge et chaude chez certains patients. Sensation parfois de cuisson avec exsudats abondants.
- Chronique : hyperpigmentation persistante, poussées récidivantes ; plaques eczémateuses nummulaires possibles entre les cuisses.
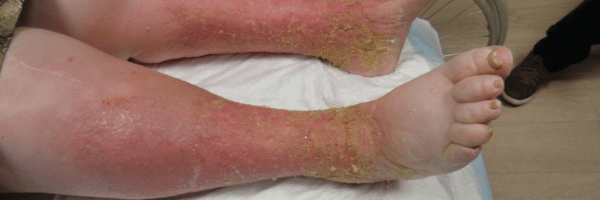
Diagnostics différentiels
- Cellulite/érysipèle : rougeur chaude, douloureuse, unilatérale, fièvre, évolution rapide.
- Dermatite de contact (allergique/irritative) : fréquente surajoutée (antiseptiques, antibiotiques topiques, excipients) → patch-tests à distance.
- Eczéma atopique, psoriasis, dermatoses purpuriques bénignes, dermopathie diabétique, xérose sévère.
Examens complémentaires (Doppler, IPS, CEAP)
- Écho-Doppler veineux : cartographie, reflux/obstruction, orientation thérapeutique.
- Indice de pression systolique (IPS) : dépistage d’artériopathie (adapter la compression veineuse).
- Classification CEAP : C4a (pigmentation/eczéma), C4b (lipodermatosclérose / atrophie blanche), C5 (ulcère cicatrisé), C6 (ulcère actif).
Complications et évolution
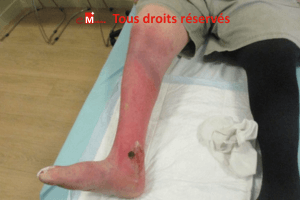
Ulcère veineux (aussi appelé ulcère variqueux), surinfection (impétiginisation, cellulite),
atrophie blanche, acroangiodermatite (pseudo-Kaposi), réaction id.
Rare : carcinome épidermoïde sur ulcère chronique (biopsie si cicatrisation lente/aspect suspect).
Prise en charge thérapeutique
Traitement étiologique (veineux)
Compression veineuse : bandages multicouches à la phase aiguë puis bas/chaussettes/collants classes 2–4 (~20 → >36 mmHg) au long cours ;
marche, surélévation. Eviter la station debout prolongée, le piétinement, les sources chaudes.
Traitement endoveineux (laser, radiofréquence) ou sclérothérapie mousse selon l’anatomie du reflux ;
phlébectomies ciblées. Veinotoniques : intérêt symptomatique modeste (appoint).
Renouvellement des bas/chaussettes/collants tous les 3 à 4 mois.
Traitement dermatologique (eczéma)
A la phase aiguë : dermocorticoïdes (classe II–III) en cures courtes, puis relais par émollients quotidiens. Si suintement : pansements adaptés (alginates de calcium/ hydrofibres/pansements superabsorbants)
Éviter topiques sensibilisants (néomycine, bacitracine, lanoline).
En cours d’évaluation : tacrolimus topique (hors AMM) ± doxycycline (données pilotes, avis spécialisé).
Gestion des complications
Antibiothérapie systémique si cellulite/ulcère infecté ; soins de plaies (nettoyage, débridement doux, antiseptiques selon contexte),
compression continue jusqu’à fermeture de la plaie variqueuse puis du lever au coucher.
Prévention et suivi
Éducation thérapeutique et hygiène
Port quotidien des bas (renouvellement 3 à 4 mois), activité physique, surélévation, hydratation cutanée.
Conseils : douche tiède (éviter chaud), vêtements non irritants, éviter chaleur et orthostatisme prolongés.
Photos utile pour suivre l’évolution.
Calendrier de suivi
Formes C4/C5 stables : contrôle trimestriel → semestriel.
Ulcère actif : suivi rapproché jusqu’à fermeture, puis espacement.
Vérifier observance, technique d’enfilage, état/renouvellement des dispositifs.
Coordination interprofessionnelle
Médecin traitant, phlébologue/angiologue, dermatologue, infirmier(ère)s,
pharmacien (éducation à la compression, adaptation des dispositifs).
Aspects pratiques (CIM-10, CEAP)
- CIM-10 : I83.1 (varices MI avec inflammation = dermite de stase) ; I83.2 si ulcère + inflammation ; I87.2 (IVC périphérique) en complément selon contexte.
- Rappel CEAP : C4a pigmentation/eczéma ; C4b lipodermatosclérose/atrophie blanche ; C5 ulcère cicatrisé ; C6 ulcère actif.
Conclusion
La dermite de stase est un marqueur cutané d’hypertension veineuse chronique.
Une prise en charge précoce et multidisciplinaire, centrée sur la compression veineuse,
les soins dermatologiques simples et, si besoin, les gestes endoveineux, réduit le risque d’ulcère veineux et de récidive.
FAQ — Dermite de stase
Qu’est-ce qu’un œdème de stase ?
Œdème des membres inférieurs lié à une hypertension veineuse chronique (reflux/obstruction), secondaire à une insuffisance veineuse chronique (IVC). Il s’accentue en fin de journée (orthostatisme),
diminue au repos avec élévation des jambes et répond à la compression veineuse.
Qu’est-ce que la dermite de stase ?
Eczéma inflammatoire des jambes sur terrain d’IVC : plaques érythémato-squameuses prurigineuses, dermite ocre (dépôts d’hémosidérine), souvent péri-malléolaire, avec risque évolutif vers l’ulcère veineux.
Quelles sont les causes de la dermite de stase ?
La cause sous-jacente est l’hypertension veineuse chronique liée au reflux valvulaire et/ou à l’obstruction (varices, syndrome post-thrombotique). Facteurs favorisants : âge, sexe féminin, multiparité, obésité, station debout prolongée, chaleur.
Quelle est la cause la plus fréquente d’un œdème de stase de la cheville ?
L’insuffisance veineuse chronique (reflux veineux superficiel et/ou profond) est la cause la plus fréquente de l’œdème de stase péri-malléolaire.
Quels sont les symptômes de la dermite de stase des jambes ?
Prurit, plaques érythémato-squameuses mal délimitées, xérose, hyperpigmentation (dermite ocre), œdème vespéral, parfois lipodermatosclérose et télangiectasies malléolaires.
Quelles sont les complications possibles de la dermite de stase ?
Ulcère veineux, surinfection (impétiginisation, cellulite), atrophie blanche, acroangiodermatite (pseudo-Kaposi), et plus rarement carcinome épidermoïde (ulcère de Marjolin) sur ulcère chronique.
Comment faire la différence entre la cellulite et la dermatite de stase ?
Cellulite : rougeur chaude, douloureuse, unilatérale, fièvre et évolution rapide, réponse aux antibiotiques.
Dermite de stase : atteinte souvent bilatérale, prurigineuse, chronique, contexte d’IVC, œdème à godet,
amélioration sous compression/élévation.
Quel est le traitement pour la dermite de stase ?
Compression veineuse (bas classes 2–4 ou bandages) + mesures posturales (marche, surélévation) pour corriger l’hypertension veineuse ; soins cutanés : dermocorticoïdes (poussées), émollients en entretien, éviter topiques sensibilisants.
Correction du reflux par gestes endoveineux (laser/radiofréquence) ou sclérothérapie si indiqué.
Quelle crème est bonne pour la dermatite de stase veineuse ?
En phase inflammatoire : corticoïde topique (puissance modérée/forte, cure courte) sur l’eczéma.
En entretien : émollient neutre quotidien. Éviter antibiotiques/anesthésiques topiques (sensibilisation).
La correction veineuse repose d’abord sur la compression.
Quel est le code CIM-10 pour la dermite de stase ?
I83.1 (varices des membres inférieurs avec inflammation = eczéma/dermite de stase).
I83.2 si ulcère + inflammation. I87.2 (IVC périphérique) peut compléter selon le contexte local de codage.
Références
- Yosipovitch G. Stasis Dermatitis: An Overview of Its Clinical Presentation, Pathogenesis, and Management. Dermatol Ther (Heidelb). 2023.
- European Society for Vascular Surgery (ESVS). 2022 Clinical Practice Guidelines on Chronic Venous Disease of the Lower Limbs. 2022.
- NICE CG168. Varicose veins: diagnosis and management. 2013.
- Cochrane Review. Compression bandages or stockings vs no compression for venous leg ulcers. 2021.
- Cochrane Review. Compression therapy for preventing venous leg ulcers returning. 2024.
- Merck Manual – Professionnel (FR). Dermatite de stase. Mise à jour récente.
- American Academy of Dermatology (AAD). Stasis dermatitis: overview & treatment. 2020–.
- DermNet NZ. Venous eczema (stasis eczema). Mise à jour.
- Singh SK. Acroangiodermatitis (Pseudo-Kaposi). Review. 2014.
- Sîrbi AG, et al. Squamous cell carcinoma developed on chronic venous leg ulcer. Rom J Morphol Embryol. 2015.
Lipodermatosclérose : définition, physiopathologie et prise en charge
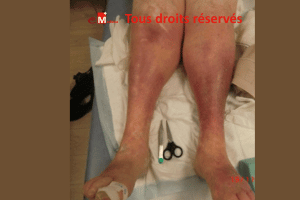
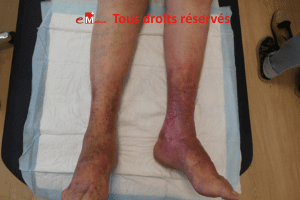
La Lipodermatosclérose est une forme avancée d’insuffisance veineuse chronique associant une hyperpression veineuse, une stase veineuse et une fibrose cutanée ; elle peut se compliquer d’un ulcère à fond scléreux. Ce guide synthétique détaille les mécanismes, les signes cliniques (dermite ocre, atrophie blanche, eczéma variqueux), les limites de la compression et les protocoles infirmiers pour accélérer la cicatrisation.
Définition de la lipodermatosclérose
La lipodermatosclérose est une inflammation du tissu adipeux sous cutané (panniculite) et du derme entraînant une fibrose dermo-hypodermique du tiers inférieur de jambe. Elle correspond à la classe CEAP C4b de l’insuffisance veineuse chronique (IVC) et évolue sur plusieurs années de stase sanguine persistante.
Physiopathologie : stase et hyperpression veineuse
L’hyperpression veineuse prolongée déclenche :
- Une activation leucocytaire → cytokines pro-fibrotiques (IL-1, TNF-α).
- Destruction de l’hypoderme de jambe et de derme puis constitution de fibrose
- Raréfaction micro-vasculaire ⇒ hypoxie tissulaire avec atrophie blanche
- eczéma de stase, dermite de stase.
Le cercle vicieux « œdème → fibrose → retour veineux aggravé » explique l’apparition de l’ulcère veineux à fond scléreux.
Epidémiologie
Environ 10% des patients atteints d’insuffisance veineuse chronique développeront une lipodermatosclérose. Une ulcération secondaire survient chez environ 13% des patients.
Diagnostic & signes cliniques
Tableau typique :
- Dermite ocre de jambe (dépôts d’hémosidérine).
- Atrophie blanche jambe : zones parcheminées, avasculaires.
- Induration circonférentielle – avec chevilles en « bouteille de champagne inversée ».
- Doppler : reflux ou obstacle, pression veineuse > 90 mmHg.
- Au toucher, la peau est dure et on ne peut pas la plisser.
- peau rouge : dermo-hypodermite chronique peut être associée
Insuffisance veineuse profonde vs superficielle : quelles répercussions ?
Maladies veineuses profondes (syndrome post-thrombotique) et superficielles (reflux saphénien) partagent la même conséquence : stase et lipodermatosclérose. L’écho-Doppler cartographie les deux systèmes pour guider une éventuelle ablation endoveineuse ou la reperméabilisation profonde.
Traitement de la lipodermatosclérose
- Mesures d’hygiène : repos jambes surélevées 2 à 3 heures par jour, marche régulière, perte de poids, surélévation des pieds du lit (10 à 20 cm) , éviter la station debout prolongée et le piétinement.
- Compression élastique 30-40 mmHg ou systèmes inélastiques.
- Médicaments : pentoxifylline, flavonoïdes.
- Correction étiologique si possible : laser ou radiofréquence pour reflux superficiel ; angioplastie/ou stenting si obstruction profonde.
- Gestion de la peau périlésionnelle : émollients + dermocorticoïdes pour dermatite de stase.
Evolution et complications
Sans correction de l’insuffisance veineuse chronique, la lipodermatosclérose progresse vers une fibrose cutanéo-tendineuse, une atrophie blanche, un eczéma de stase et surtout un ulcère veineux récidivant.
La présence de lipodermatosclérose autour d’un ulcère est un facteur pronostique majeur de retard de cicatrisation et de récidive.
Une sclérose importante au niveau de la cheville, peut entrainer une raideur voire une ankylose de cheville. Cela entraine une limitation du retour veineux.
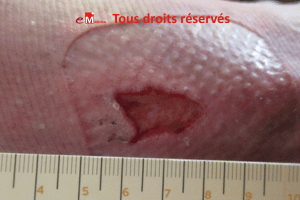
Ulcère veineux à fond scléreux : une gestion complexe
La sclérose se définit comme un développement anormal du tissu conjonctif entraînant une altération de la structure de la peau avec peu de cellules et peu de vaisseaux. La conséquence est un durcissement du fond de la plaie et des tissus environnants ainsi qu’une perte d’élasticité de la peau.
La sclérose est synonyme de fibrose. On parle alors d‘ulcère à fond « fibreux » ou « scléreux ». On peut lire aussi parfois ulcère « fibro-scléreux ».
Il y a souvent une inflammation chronique de la peau périphérique (dermite chronique ou dermo-hypodermite chronique) il peut y avoir aussi une atrophie (raréfaction des cellules avec aspect blanc = atrophie blanche).
La cicatrisation est souvent plus lente qu’un ulcère veineux standard. Cela vient du fait de la présence de peu de cellules et de la vascularisation insuffisante. Il faut donc en informer le patient et ne pas se décourager.
Le traitement de l’ulcères scléreux
Soins de base
Le fond fibreux de l’ulcère peut être pris pour de la fibrine mais en passant la curette, on retrouve une sensation de dureté de crissement comme de la pierre. Le fond saigne très vite.
Parfois on observe quelques zones rouges témoin de la présence de quelques vaisseaux ou de rares bourgeons.
La plaie est souvent très douloureuse notamment lors de la détersion.
Elle a tendance à s’agrandir en cas de lavage ou de détersion trop agressive ou de pansement inadapté : elle se rapproche du cas des plaies pathergiques comme l‘angiodermite nécrotique ou le pyoderma gangrenosum
lavage très doux sans frotter et limiter la détersion au maximum.
On peut utiliser des anesthésiants locaux comme la LIDOCAINE en gel et au besoin des antalgiques par voie orale en complément lors des soins.
Compression comme décrite plus haut.
Pansements possibles en première intention
- Hydrofibre/alginate (exsudats + à ++).
- Mousse silicone (exsudat ±).
Pansements à éviter : hydrogels et pansements hydro-balancés (macération bordure), TPN, pansements trop adhérents.
Traitements de seconde intention
La greffe cutanée est utile pour relancer la cicatrisation en particulier le bourgeonnement même si la prise de greffe n’est pas toujours bonne.
L’électrostimulation peut permettre de favoriser le bourgeonnement, diminuer la douleur avec la possibilité d’effecteur une greffe de couverture de qualité dans un second temps après avoir obtenu un bourgeonnement homogène de la plaie.
Le gel de PRP peut favoriser le bourgeonnement et l’antalgie en protégeant bien les bords
La matrice dermique acellulaire, intermédiaire entre un pansement et une greffe, peut relancer la cicatrisation.
La luminothérapie LED ou laser infrarouge peut contribuer à stimuler les cellules de la cicatrisation.
Compression et tissus scléreux : limites & solutions
La fibrose rend la peau « incompressible » ; la pression interface mesurée reste < 40 mmHg malgré un bandage classique. Solutions :
- Dispositifs de bandage multicouche avec bandes à extension courte
- Compression pneumatique intermittente si œdème persistant.
Suivi infirmier
Tracer la surface de plaie, photos régulières, éduquer à l’élévation des jambes, éviter station debout prolongée, surveiller l’oedème de stase.

FAQ – Lipodermatosclérose
Qu’est-ce que la lipodermatosclérose ?
Il s’agit d’une panniculite inflammatoire avec fibrose cutanée due à une insuffisance veineuse chronique sévère et une stase veineuse prolongée.
La lipodermatosclérose est-elle grave ?
Oui : elle prédispose à l’ulcère veineux scléreux, douloureux et long à cicatriser, et signale souvent une maladie veineuse avancée.
Quelle est la cause principale de la lipodermatosclérose ?
Une hyperpression veineuse chronique : reflux saphénien non traité, syndrome post-thrombotique, obstruction iliaque, ou combinaison des deux.
La compression peut-elle devenir inefficace ?
Oui. Quand les tissus deviennent très durs, la pression se transmet mal. Utilisez des bandes inélastiques et complétez éventuellement avec des séances de compression pneumatique intermittentes.
Comment traiter la lipodermatosclérose ?
Compression adaptée, traitement étiologique veineux, soins cutanés pour dermite ocre et eczéma de stase, exercices veineux et perte de poids.
Sources
Combien de temps met une plaie profonde à cicatriser ? Guide professionnel complet
Le temps de cicatrisation d’une plaie profonde dépend surtout de sa surface et du terrain/âge, davantage que de la profondeur isolée. Plus la plaie est large et ancienne, plus la fermeture est lente, quel que soit son volume.
Étapes et délais : étape cicatrisation plaie
La cicatrisation cutanée normale suit quatre phases successives et chevauchantes :
- Phase vasculaire (hémostase) : formation du caillot et arrêt du saignement, en quelques minutes (≈ 8 min chez un sujet sans trouble de coagulation ni anticoagulant).
- Phase inflammatoire : 24–48 h (peut s’étendre quelques jours selon le contexte).
- Phase proliférative : bourgeonnement plaie (tissu de granulation rouge vif), contraction et épidermisation/épithélialisation à partir des berges.
- Phase de maturation : remodelage collagénique prolongé ; l’aspect « définitif » d’une cicatrice survient vers 12–18 mois (notamment après brûlure).
Ce que montrent les études modernes :
- L’âge ralentit la cicatrisation (inflammation prolongée, stress oxydant accru).
- La surface initiale et l’ancienneté de la plaie sont des déterminants majeurs des délais ; la profondeur est moins prédictive en pratique clinique.
Chronologie et chronicité : quand une plaie aiguë devient chronique ?
- Une plaie aiguë bien prise en charge diminue régulièrement de taille.
- Si après 6 semaines aucune amélioration n’est visible, la plaie est considérée comme chronique et doit être réévaluée (étiologie : ulcère veineux, pression/ischémie, pied diabétique…).
- Trajectoire attendue (ordre de grandeur clinique) : –20 à –30 % de surface toutes les ~3 semaines. Des repères validés selon l’étiologie : ≥30–50 % à 4 semaines prédit une forte probabilité de cicatrisation à 12 semaines ; en deçà, le risque d’échec augmente et un changement de stratégie s’impose.
- Après 3 mois, les chances de fermeture complète chutent nettement ; dans plusieurs cohortes, ~30 % des DFU/pressions et ~45 % des VLU seulement sont cicatrisés à 12 semaines malgré soins optimaux.
Facteurs influençant la vitesse de cicatrisation
Localisation : tronc, membres supérieurs et visage cicatrisent en général plus vite (vascularisation riche, moindres contraintes mécaniques). Le talon est particulièrement lent (pression/ischémie, PAD fréquente) et présente des taux d’échec plus élevés.
Terrain & hygiène de vie : âge, tabagisme, diabète, dénutrition, artériopathie, insuffisance veineuse, corticoïdes/immunosuppresseurs, faible observance sont les principaux facteurs de retard de cicatrisation.
Type de plaie :
- Plaie chirurgicale (fermeture primaire) : 14–21 jours pour l’épidermisation initiale selon site et tension → temps de cicatrisation d’une plaie chirurgicale.
- Plaie traumatique (seconde intention) : objectif ≤ 6 semaines si faible surface et prise en charge optimale.
- Ulcères veineux/pressions/pied diabétique : tendance à la chronicisation, surtout si > 4–6 semaines sans réduction de surface.
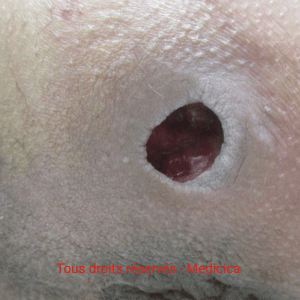
Évaluation et traitement : TIME & Wound Hygiene
Un bilan précis et étiologique est indispensable (insuffisance veineuse, hyperpression localisée, ischémie, infection/biofilm, dénutrition…).
Les pratiques actuelles s’articulent autour de :
- Modèle TIME (Tissue, Infection/Inflammation, Moisture, Edge) : préparation du lit de la plaie, contrôle de l’infection/inflammation, équilibre hydrique, stimulation du rebord.
- ou plus récemment le Wound Hygiene (2020–2022) : protocole systématique à chaque changement de pansement : détersion mécanique régulière (le plus tôt possible, dans la 1ᵉʳe semaine), nettoyage lit/péri‑lésionnel, refashioning des berges, et stratégies anti‑biofilm.
Choix des pansements (selon aspect/exsudat) :
- Plaie profonde : souvent très exsudative / plaie qui suinte : de type absorbant (alginate/fibres, super‑absorbants, hydrofibres), avec changements initiaux quotidiens puis espacés.
- Plaie plus superficielle/modérément exsudative : hydrocellulaires (mousses) ou interfaces non adhérentes, visant le milieu humide.
- Phase d’épidermisation/épithélialisation : pansements peu absorbants et protecteurs, espacement des soins.
Dispositifs complémentaires :
- Décharge systématique des ulcères plantaires diabétiques (plâtre de contact total ou dispositif équivalent non amovible en première intention).
- Contention veineuse adaptée (VLU).
- NPWT, greffes/substituts cutanés selon indications.
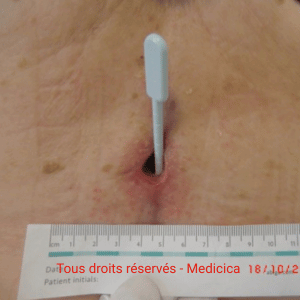
Suivi : mesure objective & critères d’alerte
- Mesurer à intervalles réguliers (photo + planimétrie) ; viser –20/–30 % de surface toutes les 3 semaines.
- Stagnation/aggravation → re‑bilan étiologique, rechercher infection/biofilm, ischémie, friction/pression, déséquilibre métabolique, défaut d’observance.
- Signes infectieux à surveiller. Exemples : douleur croissante, exsudat abondant, odeur, changement de couleur, aggravation rapide.
- Réévaluation spécialisée si absence d’évolution après 1 mois de soins adaptés.
Ce que nous enseignent les études
- Observations historiques (Carrel, Lecomte du Nouÿ, A. Lumière) :
- Vitesse de cicatrisation inversement corrélée à la surface ; non linéaire : rapide en granulation, plus lente en épithélialisation.
- Les petites plaies ferment nettement plus vite que les grandes.
- Au‑delà de ~150 cm², l’âge influence peu la vitesse ; recours à une greffe souvent nécessaire. Ces lois historiques ont ouvert la voie aux modèles modernes et restent utiles pour penser la trajectoire de cicatrisation, sans remplacer les recommandations actuelles.
- Études récentes : confirment que l’ancienneté, la surface et la localisation (ex. talon) sont des prédicteurs majeurs du délai et du risque d’échec.
Prédire le temps de cicatrisation : modèles pratiques
- Modèle de Lecomte du Nouÿ : courbe exponentielle décrivant la réduction de surface au cours du temps ; utile pour comparer le réel à l’attendu.
- Méthode d’Auguste Lumière (empirique, clinique) : mesurer régulièrement (p. ex. tous les 15 jours) la largeur maximale de la plaie une fois la détersion efficace.
Exemple chiffré :
– 15 déc. : largeur = 30 mm
– 30 déc. : largeur = 20 mm → vitesse = 0,6 mm/j
→ Temps prévisionnel pour fermer une plaie de 20 mm ≈ 33 jours → cicatrisation attendue ~31 janv.
À retenir : ces modèles aident à anticiper et objectiver l’évolution ; ils n’exonèrent pas d’une réévaluation rapide si la trajectoire déraille (<30–50 % à 4 semaines selon l’étiologie).
Conclusion
La durée de cicatrisation d’une plaie profonde dépend avant tout de sa surface, de son ancienneté et du terrain. Une plaie récente, bien évaluée (étiologie) et soignée précocement (TIME + Wound Hygiene, contrôle étiologique, décharge/stratégies spécifiques) a de fortes chances d’évoluer favorablement en quelques semaines. À l’inverse, une plaie chronique ou mal surveillée voit ses délais nettement allongés ; un suivi précoce, rigoureux et personnalisé reste la clé.
FAQ
1. Combien de temps met une plaie profonde à cicatriser ?
Cela dépend surtout de la surface, de l’ancienneté et du terrain du patient. Une plaie récente et bien prise en charge évolue en quelques semaines, tandis qu’une plaie chronique peut durer plusieurs mois.
2. Quelles sont les différentes étapes de la cicatrisation et combien de temps dure chacune ?
- Phase vasculaire (hémostase) : quelques minutes.
- Phase inflammatoire : 24 à 48 heures.
- Phase proliférative : apparition du tissu de granulation et début d’épithélialisation pendant plusieurs jours à semaines.
- Phase de maturation : remodelage cicatriciel sur 12 à 18 mois.
3. Quand peut-on considérer qu’une cicatrice est définitive ?
Au terme de la phase de maturation, soit après 12 à 18 mois.
4. Quelle est la partie du corps qui cicatrise le moins vite ?
Le talon est la zone la plus lente (pression et ischémie locales fréquentes).
5. Combien de temps faut-il pour qu’une croûte tombe ?
La croûte se détache spontanément lors de l’épithélialisation. Le délai varie selon la surface et l’équilibre hydrique de la plaie. Il ne faut pas l’arracher car cela entraîne un retard de cicatrisation et un risque de cicatrice pathologique.
6. Quelle est la durée moyenne de cicatrisation d’une plaie profonde selon l’âge ou l’état de santé ?
La vitesse diminue avec l’âge et les comorbidités (diabète, dénutrition, tabagisme, pathologies vasculaires). Chez un sujet âgé ou fragilisé, le délai est significativement prolongé.
7. Quelle est la durée type de cicatrisation selon la profondeur ou le type de plaie ?
- Plaie chirurgicale : 14–21 jours.
- Plaie traumatique : ≤ 6 semaines.
- Plaie chronique (ulcère, escarre, pied diabétique) : souvent > 3 mois sans prise en charge spécifique.
8. Temps cicatrisation coupure doigt / temps de cicatrisation d’une plaie profonde doigt :
Cela dépend de la surface, de la mobilisation (immobilisation/attelles si besoin), du contrôle de l’humidité et du risque d’infection. Le doigt cicatrise bien grâce à sa vascularisation riche, mais la contrainte mécanique peut ralentir l’épithélialisation.
9. Temps de cicatrisation point de suture :
Varie selon la localisation et la tension cutanée ; l’ablation est protocolisée par le chirurgien. La cicatrisation plaie chirurgicale suit les mêmes phases que toute plaie cutanée.
10. Temps de cicatrisation griffure visage / temps cicatrisation plaie visage :
Le visage cicatrise plus vite (vascularisation importante), avec un suivi cicatriciel prolongé pour optimiser la maturation (12–18 mois).
11. Délai pour suturer une plaie :
Généralement dans les six heures. Mais décision médicale selon l’âge de la lésion, son degré de contamination, la localisation (ex. visage), le risque ischémique et l’état général. Objectif : restaurer l’anatomie, réduire l’infection et optimiser la cicatrisation.
12. Plaie peau arrachée (skin tear) :
Haut risque de chronicisation ; privilégier une détersion douce, une ré‑apposition si possible, protection des berges et panssements adaptés favorisant un milieu humide.
13. Comment accélérer la cicatrisation d’une plaie profonde ?
En assurant un contrôle étiologique, un milieu humide, une détersion régulière, une bonne observance (décharge, contention) et un suivi rapproché.
14. Comment faire cicatriser une plaie profonde rapidement ?
Appliquer le modèle TIME et le concept de Wound Hygiene : détersion précoce, pansements adaptés à l’exsudat, prise en charge du biofilm, dispositifs complémentaires selon le type de plaie.
15. Quels facteurs peuvent retarder la cicatrisation ?
Âge avancé, tabac, diabète, dénutrition, insuffisance veineuse ou artérielle, corticothérapie/immunosuppresseurs, mauvaise observance.
16. Quels facteurs de risque faut-il identifier et quantifier ?
Les principaux sont : dénutrition, pathologies vasculaires, diabète, âge, traitements immunosuppresseurs et manque d’adhésion du patient aux soins.
17. Comment évaluer la profondeur, la taille et le type d’une plaie ?
Par un bilan clinique précis incluant mesure régulière (planimétrie, photos), analyse du lit de la plaie (tissu nécrotique, fibrine, bourgeonnement) et de la peau péri-lésionnelle.
18. Comment distinguer une plaie aiguë d’une plaie chronique ?
Une plaie aiguë régresse de façon régulière. Après 6 semaines sans amélioration, elle est considérée comme chronique.
19. Comment nettoyer correctement une plaie profonde ?
L’article indique la nécessité d’une détersion mécanique régulière et d’un nettoyage soigneux à chaque changement de pansement.
22. Quels soins ou produits sont recommandés pour une plaie profonde ?
Des panssements absorbants (alginate, hydrofibres, super-absorbants) pour les plaies exsudatives, des hydrocellulaires pour les plaies superficielles, et des pansements protecteurs en phase d’épithélialisation.
23. Comment choisir le pansement adapté ?
Selon l’aspect, le niveau d’exsudat et la phase de cicatrisation (prolifération vs épithélialisation).
24. À quelle fréquence changer un pansement sur une plaie profonde ?
Initialement tous les jours, puis espacement progressif selon l’évolution et le type de pansement.
26. Quand utiliser des produits topiques spécifiques ou des thérapies avancées ?
Selon indications : NPWT, greffes ou substituts cutanés en cas de plaies complexes ou stagnantes.
27. Comment accompagner le patient dans l’hygiène de vie ?
Éducation thérapeutique centrée sur l’observance, la décharge, la contention, la nutrition et l’arrêt du tabac.
28. Comment savoir si la cicatrisation se déroule normalement ?
On attend une diminution de 20–30 % de la surface toutes les 3 semaines.
29. Quels sont les signes normaux et anormaux ?
Normaux : régression progressive, bourgeonnement rouge vif, formation d’épithélium.
Anormaux : stagnation, aggravation, bourgeonnement terne, nécrose.
30. Quels sont les signes d’infection ? Quand consulter ?
Douleur croissante, exsudat abondant, odeur, changement de couleur, aggravation rapide. Consultation si absence d’évolution après 1 mois de soins adaptés.
31. Quand faut-il s’inquiéter ou consulter ?
Si la plaie n’évolue pas favorablement après 1 mois ou en cas de signes infectieux.
32. Quels sont les indicateurs de cicatrisation normale ou pathologique ?
Réduction régulière de surface ; stagnation ou aggravation sont des indicateurs pathologiques.
33. Quels critères permettent d’ajuster le traitement ?
Évolution de la surface, aspect du lit de la plaie, contrôle de l’exsudat, signes d’infection.
34. Peut-on prévoir la fin de la cicatrisation ?
Oui, grâce aux modèles de Lecomte du Nouÿ ou de Lumière, en comparant la vitesse réelle de fermeture à une courbe attendue.
36. Quels protocoles de surveillance permettent d’anticiper une infection ?
Surveillance régulière avec mesure, photos, recherche de douleur, exsudat, odeur, aggravation. Application systématique du concept de Wound Hygiene.
37. Quand référer un patient à un spécialiste ?
En cas d’absence d’évolution après 1 mois de soins optimisés, ou devant une plaie complexe/chronique nécessitant greffe, décharge spécialisée ou évaluation chirurgicale.
39. Plaie peau arrachée (skin tear) ?
Haut risque de chronicisation ; privilégier détersion douce, ré‑apposition si possible, protection des berges et panssements favorisant un milieu humide.
Références
- Wallace HA, et al. Wound Healing Phases. StatPearls ; mise à jour 2023. Lien : https://www.ncbi.nlm.nih.gov/books/NBK470443/
- Glynn E, et al. Wound Healing: A Comprehensive Review. Plast Reconstr Surg Glob Open 2021;9:e2427. Lien : https://pmc.ncbi.nlm.nih.gov/articles/PMC8432991/
- Loddo I, et al. Aging and Wound Healing of the Skin. Biomedicines 2022;10:2819. Lien : https://pmc.ncbi.nlm.nih.gov/articles/PMC9784880/
- Marston WA, et al. Baseline factors affecting closure of venous leg ulcers. J Vasc Surg Venous Lymphat Disord 2017. Lien : https://www.jvsvenous.org/article/S2213-333X(17)30351-7/fulltext
- Fife CE, et al. The Wound Healing Index for Predicting VLU Healing. Adv Wound Care 2019. Lien : https://pmc.ncbi.nlm.nih.gov/articles/PMC6940587/
- Cho SK, et al. Model to Predict Healing of Chronic Wounds. Adv Wound Care 2020;9(10):602–611. Lien : https://pmc.ncbi.nlm.nih.gov/articles/PMC7522633/
- Bossert J, et al. Educational interventions in VLU. Int Wound J 2022;19:1867–1881. Lien : https://pmc.ncbi.nlm.nih.gov/articles/PMC10088831/
- Harries RL, et al. Wound bed preparation – TIME update. Int Wound J 2016;13(S3):17–22. Lien : https://pmc.ncbi.nlm.nih.gov/articles/PMC7949772/
- Atkin L, et al. Defying hard‑to‑heal wounds: Wound Hygiene. J Wound Care 2020;29(Sup3b):S1–S26. Lien : https://www.magonlinelibrary.com/doi/full/10.12968/jowc.2020.29.Sup3b.S1
- Atkin L, et al. Embedding Wound Hygiene… J Wound Care 2022;31(Sup4a):S1–S26. Lien : https://www.magonlinelibrary.com/doi/full/10.12968/jowc.2022.31.Sup4a.S1
- Bowers S, Franco E. Chronic Wounds: Evaluation and Management. Am Fam Physician 2020;101:159–166. Lien : https://www.aafp.org/pubs/afp/issues/2020/0201/p159.html
- Bus SA, et al. (IWGDF) Offloading guideline 2023. Diabetes Metab Res Rev 2024 (publié en ligne 2023). Lien : https://iwgdfguidelines.org/wp-content/uploads/2023/07/IWGDF-2023-06-Offloading-Guideline.pdf
- Rivolo M, et al. Heel Pressure Injuries: Consensus. Int Wound J 2020;17:701–711. Lien : https://pmc.ncbi.nlm.nih.gov/articles/PMC7155923/
- Le Linn Y, et al. Ischaemic heel ulcers outcomes post‑revascularisation. Ann Vasc Surg 2020. Lien : https://pmc.ncbi.nlm.nih.gov/articles/PMC7949176/
- Walker RM, et al. Foam dressings for pressure ulcers. Cochrane 2017. Lien : https://pmc.ncbi.nlm.nih.gov/articles/PMC6485618/
- Britto EJ, et al. Wound Dressings. StatPearls ; mise à jour 2024. Lien : https://www.ncbi.nlm.nih.gov/books/NBK470199/
- Ngo QC, et al. Computerised prediction of healing for VLUs. Sci Rep 2022;12:17551. Lien : https://www.nature.com/articles/s41598-022-20835-y
- RCH Melbourne Wound assessment & management guideline. 2023. Lien : https://www.rch.org.au/rchcpg/hospital_clinical_guideline_index/Wound_assessment_and_management/
- Wounds‑UK A five‑level model for wound analysis (réf. Lecomte du Nouÿ). 2016. Lien : https://wounds-uk.com/wp-content/uploads/2023/02/d3a4c3332d96b6a16ad527528556de95.pdf
Note historique : Les lois de Carrel, Lecomte du Nouÿ et Auguste Lumière datent du début du XXᵉ siècle ; elles ne se substituent pas aux recommandations récentes ci‑dessus.

