Infirmier expert en cicatrisation : pourquoi attendre un poste qui n’existe pas ?

Mon ulcère veineux coule trop : que faire
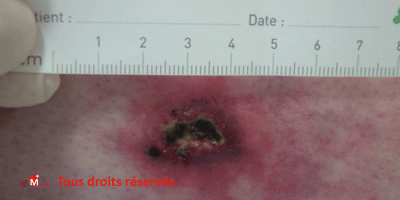
Angiodermite nécrotique (ulcère de Martorell) : signes, diagnostic, traitement
L’angiodermite nécrotique est un type d’ulcère ischémique particulièrement douloureux du membre inférieur, souvent confondu avec d’autres plaies chroniques de jambe. Cette pathologie, encore trop souvent méconnue, nécessite une prise en charge spécifique et rapide. Découvrez comment l’identifier, la différencier et la traiter efficacement en pratique clinique, la greffe restant le traitement le plus efficace.
Qu’est-ce que l’angiodermite nécrotique ?
L’angiodermite nécrotique (aussi appelée « angiodermite nécrosante », « ulcère de Martorell », « ulcère suspendu », « ulcère hypertensif », vasculopathie livedoïde) est une plaie cutanée ischémique liée à une microangiopathie artériolaire des membres inférieurs. Elle est due à une occlusion des petites artères du derme, dans un contexte d’hypertension artérielle ancienne, parfois de diabète ou d’insuffisance veineuse chronique.
Quelle est la cause de l’angiodermite nécrotique ?
L’origine précise de cette maladie reste mal connue : on suspecte un rôle central des atteintes vasculaires (microangiopathie hypertensive), mais d’autres facteurs sont probablement impliqués.
Quel est le terrain de l’angiodermite nécrotique ?
Bien que l’angiodermite nécrotique soit souvent présentée comme une maladie rare, elle peut représenter jusqu’à 10 à 15 % des ulcères de jambe dans certaines études. Elle atteint en priorité les femmes de plus de 65 ans, mais peut aussi toucher les hommes. Le terrain vasculaire est constant : hypertension artérielle ancienne, diabète, parfois insuffisance veineuse. La bilatéralité et la symétrie sont possibles : une même lésion peut se développer sur les deux jambes. Il n’y a jamais d’angiodermite nécrotique au-dessus du genou ou au niveau du pied.
Quels sont les signes cliniques typiques ?
- La lésion démarre généralement après un traumatisme minime à la jambe.
- Elle débute par une rougeur, évolue vers un aspect violacé, puis une nécrose cutanée avec formation rapide d’une ulcération extrêmement douloureuse.
- La douleur est d’emblée intense et permanente, même la nuit, sans position de soulagement.
- L’ulcération s’étend de façon centrifuge, à partir d’une bordure rouge et violacée (livédo).
- L’évolution peut être aggravée par le frottement ou une détersion agressive, traduisant un phénomène de pathergie.
Comment diagnostiquer l’angiodermite ?
Le diagnostic est avant tout clinique.
À l’examen, la plaie est nécrosée, à bords nets, peu exsudative, souvent localisée sur la partie antéro-externe du tibia, parfois de manière bilatérale et symétrique. Elle peut aussi se situer en regard de la zone achilléenne (exemple : suite à un frottement sur le talon d’une chaussure). La périphérie violacée (« livédoïde ») est caractéristique.
Un bilan doppler artériel des membres inférieurs est indispensable : il permet d’exclure une artérite sévère.
Quelle est la place de la biopsie ? Elle est proposée en cas de doute diagnostic.
Quels sont les diagnostics différentiels ?
- Ulcère artériel : terrain d’artériopathie, localisation plutôt au pied ou aux orteils, absence de microangiopathie
- Pyoderma gangrenosum : ulcère très inflammatoire, bords violacés, contexte de maladie systémique
- Ulcères veineux : bords irréguliers, exsudat abondant, douleur moins intense
- Nécrose cutanée d’autres origines : calciphylaxie en cas d’insuffisance rénale chronique sévère
Le patient peut parfois avoir une insuffisance veineuse associée ou une artériopathie oblitérante des membres inférieures mais celle-ci ne doit pas être suffisamment sévère pour expliquer la présence de l’angiodermite nécrotique.
Tableau résumé des diagnostics différentiels
| Diagnostic | Localisation | Douleur | Terrain | Aspect de la plaie |
|---|---|---|---|---|
| Angiodermite nécrotique | Tibia antéro-externe mais jamais au dessus du genou et au niveau du pied | Intense, permanente | Femme >65 ans, HTA, diabète | Nécrose noire, bords nets, extension centrifuge, livedo périphérique |
| Ulcère artériel | Pied, orteils, suspendu | Intense | Artériopathie | Nécrose sèche, creusante |
| Pyoderma gangrenosum | Jambe, périostéal | Variable | Maladie systémique | Bords violacés, très inflammatoire |
| Ulcère veineux | Plutôt malléolaire | Modérée | Insuffisance veineuse | Bords irréguliers, exsudat |
| Calciphylaxie cutanée | Jambe, cuisse | Très douloureux | IRC sévère | Nécrose, calcifications sous-cutanées |
Quels sont les facteurs favorisants ?
L’angiodermite nécrotique est surtout liée à une microangiopathie hypertensive, secondaire à une HTA ancienne. Les facteurs de risque : hypertension artérielle, diabète, âge avancé, insuffisance veineuse, obésité.
Des facteurs favorisants : traumatisme même minime, friction, parfois gestes de soins inadaptés (détersion agressive). Attention à la calciphylaxie cutanée chez les patients en insuffisance rénale chronique sévère : le diagnostic différentiel est parfois difficile.
Comment soigner une angiodermite nécrotique ?
Séquence du traitement
- Repos +++ et traitement efficace de la douleur (antalgiques palier II/III) en premier lieu
- Greffe précoce +++ : traitement principal, permettant un soulagement rapide de la douleur et un arrêt de la poussée
- Soins locaux : pansements doux, éviter toute friction ou détersion agressive (phénomène de pathergie).
- La douche n’est pas contre-indiquée, à condition de respecter un faible débit
- Compression non recommandée
- Contrôle strict de la tension artérielle et correction des facteurs de risque cardiovasculaires
- Traitements complémentaires possibles : corticoïdes topiques forts, thérapie par pression négative, PRP en gel, matrices dermiques, anticoagulants (en cours d’évaluation), électrothérapie (prometteuse)
- Prévention des complications : surinfection : prélèvement bactériologique, antibiothérapie adaptée si besoin
- Prise en charge pluridisciplinaire (médecin, infirmier expert en plaies, dermatologue, chirurgien plasticien)
Quelles sont les indications d’hospitalisation ?
L’hospitalisation est souvent nécessaire en cas de lésion étendue ou de douleur incontrôlable.
La stratégie thérapeutique dépend de l’ancienneté de la plaie et de la réponse au traitement. Des traitements spécialisés peuvent être nécessaires pour obtenir la cicatrisation complète.
Suivez ma formation pour établir une stratégie adaptée.
Quelles sont les complications possibles et l’évolution ?
Comme toute plaie chronique, l’angiodermite nécrotique expose à plusieurs complications :
- Surinfection bactérienne : le risque de surinfection locale est élevé, surtout chez les patients fragiles. Un prélèvement bactériologique est indiqué devant tout signe clinique d’infection.
- Douleur chronique invalidante : la douleur peut persister longtemps et altérer la qualité de vie, nécessitant parfois une prise en charge antidouleur spécialisée.
- Retard de cicatrisation : certaines lésions évoluent lentement malgré une prise en charge optimale, notamment en cas de terrain défavorable (diabète, âge avancé).
- Extension ou récidive : l’ulcère peut s’étendre de façon centrifuge, ou réapparaître sur l’autre jambe (atteinte bilatérale possible).
- Exposition tendineuse ou osseuse possible selon les localisations
- Risque d’amputation : exceptionnel mais possible en cas d’évolution défavorable, d’infection profonde ou de perte de substance importante.
Par ailleurs, il n’existe pas de risque dégénératif connu (transformation maligne) associé à l’angiodermite nécrotique.
Combien de temps pour cicatriser ?
La durée de cicatrisation d’une angiodermite nécrotique est variable : elle dépend du terrain, de la précocité du diagnostic, et de la rapidité de mise en place d’une greffe cutanée. Avec une prise en charge adaptée, la greffe permet souvent une cicatrisation en quelques semaines. Sans greffe, l’évolution est généralement lente : plusieurs mois sont parfois nécessaires pour obtenir la fermeture complète de la plaie.
Un suivi spécialisé est recommandé jusqu’à cicatrisation complète pour prévenir la récidive.
Quelle prévention des récidives proposer ?
- Équilibration du diabète et de l’hypertension artérielle
- Crémage régulier des jambes
- Éviter les chocs (protection des jambes)
z
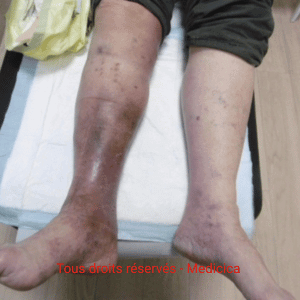
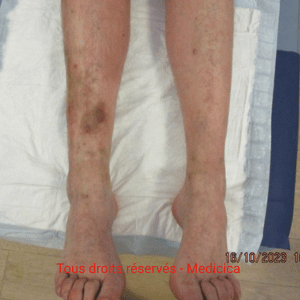
Cas cliniques et photos
Illustrations cliniques : deux présentations contrastées d’angiodermite nécrotique
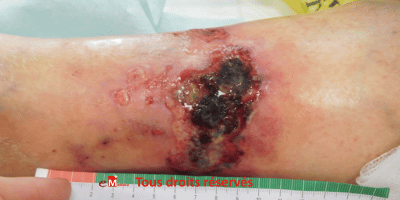
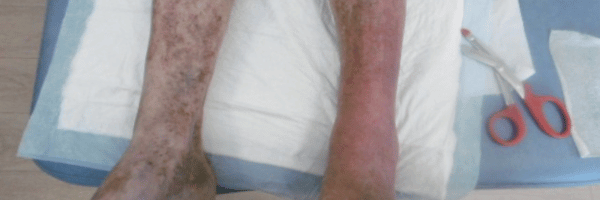
Cas clinique n°1 : une angiodermite nécrotique particulièrement récalcitrante
Cas clinique : une plaie rétive et évolutive
Un homme de 76 ans consulte pour une lésion
malléolaire externe droite, d’environ 1,5 cm,
apparue dix jours plus tôt après un traumatisme minime. La plaie est
d’emblée extrêmement douloureuse, s’étend de manière centrifuge et présente
une nécrose cutanée rapidement progressive. Le terrain est typique :
hypertension artérielle ancienne et diabète de type 2.
Un Doppler artériel ne retrouve pas d’artériopathie sévère, ce qui oriente
vers une angiodermite nécrotique. La lésion étant récente, une
greffe en pastilles est indiquée pour stopper la poussée et soulager la
douleur. La première semaine est favorable, mais dès la deuxième semaine, la
douleur réapparaît et la nécrose reprend, signe d’échec partiel.
Une électrostimulation est tentée avec un soulagement incomplet.
L’angiodermite continue pourtant de s’étendre. Peu après, la situation se
dégrade brutalement avec fièvre, creusement et
contact osseux. Le scanner confirme une ostéoarthrite,
imposant une prise en charge urgente par le chirurgien plasticien.
Deux lavages articulaires sont réalisés avec prélèvements, suivis
d’une antibiothérapie. Un lambeau est posé. Malgré une
évolution d’abord favorable, une nouvelle zone de nécrose apparaît à
J+15. Une greffe complémentaire est tentée, puis deux greffons en pastilles
sont appliqués en consultation suite à une nouvelle nécrose localisée.
Ce cas illustre la complexité extrême de certaines angiodermites
nécrotiques, parfois réfractaires malgré une prise en charge rigoureuse,
multidisciplinaire et rapidement initiée.
Enseignements du cas n°1
- Hyperalgie persistante : la réapparition de la douleur est un signal d’extension nécrotique.
- Greffe précoce parfois insuffisante : certaines angiodermites restent réfractaires malgré une stratégie optimale.
- Creusement + fièvre = urgence : évoquer une atteinte profonde (osteoarthrite, ostéite).
- Nécessité d’une équipe pluridisciplinaire : chirurgien plasticien, infectiologue, équipe douleur, infirmier expert.
- Évolution imprévisible : récidives de nécrose possibles même après lambeau et greffes multiples.
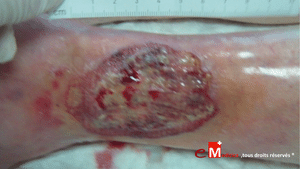
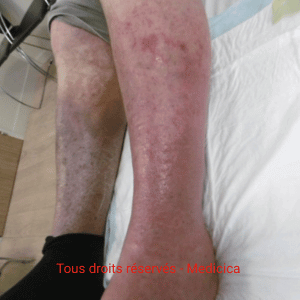
Cas clinique n°2 : une angiodermite nécrotique stabilisée par l’adaptation des soins
Cas clinique : une forme contrôlée par des soins ultra-doux
Une patiente octogénaire, hypertendue, présente une plaie très douloureuse
après un choc contre une table basse, au niveau du tibia gauche. La lésion,
d’environ 1 cm, est inflammatoire, lentement extensive, avec un
livedo périphérique.
Elle décrit des douleurs intermittentes intenses et de fortes douleurs
nocturnes. Les soins déclenchent eux-mêmes une douleur prolongée. Les pouls
sont difficilement perceptibles, et un bilan est programmé pour éliminer une
AOMI sévère ou une infection chronique.
Dans l’attente, des soins ultra-doux sont prescrits : arrêt du frottement,
simple tamponnement, et interruption de la détersion mécanique. Les
bilans ne retrouvent ni AOMI sévère ni infection.
Quinze jours plus tard, la patiente est nettement soulagée : la périphérie
n’est plus inflammatoire, et un début de cicatrisation apparaît.
Une pathergie induite par des soins trop agressifs est suspectée.
Les soins doux sont poursuivis. Devant un œdème associé, une
contention légère à faible élasticité est mise en place, bien tolérée,
sans réactivation de l’angiodermite. La plaie cicatrise en
deux mois, sans intervention supplémentaire.
Ce cas montre qu’une simple adaptation des soins locaux, respectant la
fragilité cutanée et limitant la pathergie, peut suffire à obtenir une
cicatrisation complète.
Enseignements du cas n°2
- Identifier la pathergie : les soins trop vigoureux aggravent l’inflammation et la douleur.
- Soins ultra-doux : tamponner au lieu de frotter, éviter la détersion mécanique.
- Exclure AOMI sévère et infection : bilans vasculaires et biologiques indispensables.
- Contention légère possible dans certains cas : utile sur l’œdème et bien tolérée si AOMI exclue.
- Approche minimaliste efficace : parfois, adapter les soins suffit à atteindre la cicatrisation.
Sources / Références
- Mansour M, Alavi A. (2019). Martorell ulcer: chronic wound management and rehabilitation. Chronic Wound Care Management and Research, 6, 83-88. https://doi.org/10.2147/CWCMR.S172427
- Senet P. (2016). Compression in hypertensive leg ulcer (Martorell’s ulcer). Veins and Lymphatics, 5(1), 5987. https://doi.org/10.4081/vl.2016.5987
- Mahé E, Montfort JB, Senet P, Nguyen-Chi HN. (2021). Prise en charge de l’angiodermite nécrotique en France. Phlébologie, 74(3), 85-89 : lien.
- Vuerstaeek JDD, Reeder SWI, Henquet CJM, Neumann HAM. (2010). Arteriolosclerotic ulcer of Martorell. JEADV, 24(8), 867-874. https://doi.org/10.1111/j.1468-3083.2009.03553.x
- Braun-Falco M, Kovnerysz E, Schliemann S, Dissemond J. (2020). Angiodermite nécrotique : un ulcère à connaître. Revue Médicale Suisse, 16(636), 636-641: lien.
- Körber A, Klode J, Al-Benna S, Wax C, Schadendorf D, Steinstraesser L, et al. (2011). Etiology of chronic leg ulcers in 31,619 patients in Germany analyzed by an expert survey. JDDG, 9(2), 116-121. https://doi.org/10.1111/j.1610-0387.2010.07535.x
- Abbade LPF, Miot HA, Orsini M, Rossi BM, Marques SA, Hamzagic F, et al. (2021). Consensus on the diagnosis and management of chronic leg ulcers. Anais Bras Dermatol, 96(3), 246-272. https://doi.org/10.1016/j.abd.2020.12.004
- Dissemond J. (2017). Chronic leg ulcers. Hautarzt, 68(8), 614-620. Lien
- Bertin A, Senet P. (2019). Ulcères veineux : lésions atypiques à ne pas méconnaître. Phlébologie, 72(4), 28-37 : lien.
Tout savoir pour prendre en charge l'angiodermite nécrotique
Suivez notre formation approfondie avec photos, protocoles de soins et de traitement.
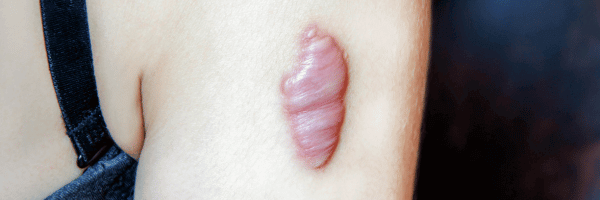
Cicatrice hypertrophique et chéloïde : diagnostic prévention et traitement
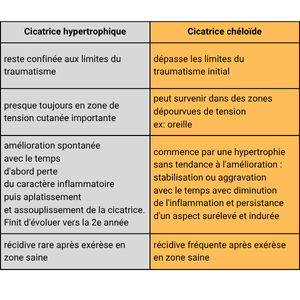
Les cicatrices hypertrophiques et les cicatrices chéloïdes représentent deux formes de cicatrisation pathologique fréquemment rencontrées après chirurgie ou traumatisme cutané. Elles partagent un mécanisme commun d’hyperprolifération fibroblastique, mais se distinguent par leur évolution clinique : la cicatrice hypertrophique reste confinée aux berges de la plaie et tend à régresser, tandis que la cicatrice chéloïde envahit les tissus sains voisins, formant une masse fibreuse persistante.
La prise en charge thérapeutique repose sur une prévention précoce (silicone, pressothérapie, hydratation) et, en cas d’évolution défavorable, sur des traitements curatifs combinés : injections de corticoïdes intralésionnelles, laser, voire chirurgie associée à une radiothérapie. L’objectif est d’obtenir une cicatrice plane, souple et indolore, tout en limitant le risque de récidive.
Sommaire
- Quelle est la différence entre cicatrice hypertrophique et cicatrice chéloïde ?
- Quelles sont les caractéristiques cliniques et histologiques d’une cicatrice hypertrophique ?
- Quelles sont les particularités de la cicatrice chéloïde ?
- Quels sont les facteurs de risque des cicatrices hypertrophiques et chéloïdes ?
- Quels traitements préventifs permettent d’éviter ces cicatrices ?
- Quels traitements curatifs peut-on proposer après six mois ?
- Quel est l’intérêt du traitement par laser ?
- Quand envisager la chirurgie et la radiothérapie ?
- Quels traitements ont démontré leur efficacité scientifique ?
- Sources
Quelle est la différence entre cicatrice hypertrophique et cicatrice chéloïde ?
Les cicatrices hypertrophiques et chéloïdes partagent une hyperprolifération dermique. La précocité du traitement chirurgical associé à la prévention secondaire a permis de réduire ces séquelles cutanées. C’est l’évolution qui va distinguer ces deux types de cicatrices.
Quelles sont les caractéristiques cliniques et histologiques d’une cicatrice hypertrophique ?
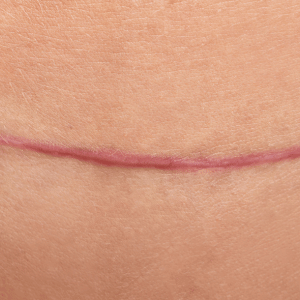
La cicatrice hypertrophique se manifeste par une lésion boursouflée, rouge, douloureuse et prurigineuse. Elle apparaît dans le mois suivant le traumatisme et reste confinée dans les limites de la plaie initiale, souvent dans les zones de tension cutanée.
Histologiquement, elle contient des myofibroblastes et du collagène de type III orienté parallèlement au derme. Elle tend à régresser spontanément après 12 à 18 mois. La récidive après exérèse chirurgicale reste rare.
Quelles sont les particularités de la cicatrice chéloïde ?
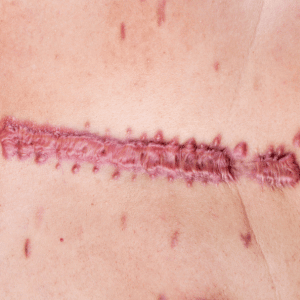
La cicatrice chéloïde débute comme une cicatrice hypertrophique mais évolue différemment. C’est une forme invasive et persistante. Elle est rare chez le brûlé.
En quoi la cicatrice chéloïde diffère-t-elle fondamentalement de la cicatrice hypertrophique ?
Elle envahit la peau saine et s’étend au-delà de la plaie initiale, formant des prolongements irréguliers parfois en « pinces d’écrevisse ». Elle apparaît même dans des zones sans tension (ex. : oreille).
Histologiquement, ses fibres de collagène sont plus épaisses et désorganisées, sans myofibroblastes, ce qui explique la fréquence des récidives après exérèse.
Quels sont les facteurs de risque des cicatrices hypertrophiques et chéloïdes ?
- Facteurs ethniques et génétiques : prévalence élevée chez les peaux noires et asiatiques.
- Âge : risque accru entre 10 et 30 ans.
- Localisation : sternum, épaules, cou, oreilles, visage, pubis, genou.
- Autres facteurs : infection, corps étranger, « peau grasse » (séborrhéique).
Quels traitements préventifs permettent d’éviter ces cicatrices ?
Pourquoi la prévention est-elle essentielle ?
La prévention débute dès la cicatrisation complète et se poursuit 6 semaines à 24 mois selon le contexte.
Le massage cicatriciel est-il efficace ?
Le massage cicatriciel (palper-rouler) favorise la souplesse et la revascularisation. Il débute trois semaines après le retrait des points.
Les pansements siliconés sont-ils un traitement clé ?
Les pansements siliconés (MEPIFORM®, CICA CARE®, LUMIDERM®…) sont le traitement de référence. Application progressive (2h/j → 16h/j), lavables et réutilisables. Pour les zones difficiles : gels de silicone (Cicaplast B5®, KELO-COTE®).
Quel est le rôle de la pressothérapie ?
Les vêtements compressifs (JOBST®, THUASNE®…) exercent une pression de 6 à 13,5 mmHg, réduisant œdème et tension cicatricielle.
Pourquoi l’hydratation cutanée est-elle importante ?
L’hydratation entretient la souplesse cutanée. Le gel de silicone s’applique matin et soir sur peau propre et sèche.
Existe-t-il d’autres traitements préventifs ?
La mécano-stimulation (LPG®) peut être proposée sur cicatrice mature et solide.

Quels traitements curatifs peut-on proposer après six mois ?
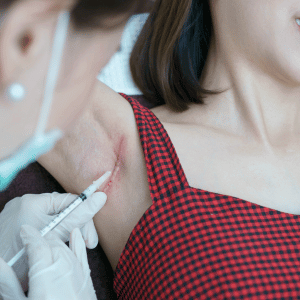
Quel est l’intérêt de la corticothérapie intralésionnelle ?
Les injections de triamcinolone acétonide (Kenacort®) réduisent l’inflammation, le prurit et l’épaisseur de la cicatrice. Applications topiques limitées pour éviter l’atrophie.
Quels sont les autres traitements injectables disponibles ?
- 5-Fluorouracile (5-FU) : aplatit les cicatrices et améliore les symptômes.
- Bléomycine : effet durable avec bonne tolérance.
Quel est l’intérêt du traitement par laser ?
Les lasers vasculaires (à colorant pulsé) ou fractionnés (CO₂, Er:YAG) réduisent la vascularisation et améliorent texture et souplesse. Le PDL est considéré comme le « gold standard ».
Quand envisager la chirurgie et la radiothérapie ?
Après un an sans amélioration, une révision chirurgicale peut être envisagée, associée à une brachythérapie post-opératoire à l’iridium 192 (4–5 fractions de 3 Gy).
Pour les lésions étendues : derme artificiel Integra® et greffe secondaire pour guider la cicatrisation.
Quels traitements ont démontré leur efficacité scientifique ?
- Pressothérapie (plaques ou gels de silicone)
- Injections de corticoïdes intralésionnels
- Correction chirurgicale ciblée
La prise en charge reste individualisée et multidisciplinaire, impliquant chirurgiens, dermatologues et radiothérapeutes.
Sources et références
- Prise en charge non chirurgicale des cicatrices hypertrophiques et chéloïdes (2018)
- Management of keloid and hypertrophic scars (2005)
- Le traitement médical des cicatrices hypertrophiques et chéloïdes (2018)
- Traitement des chéloïdes : où en sommes-nous ? Revue Médicale Suisse (2019)
- Management of Keloids and Hypertrophic Scars, American Family Physician (2024)
- Management of Keloids and Hypertrophic Scars (2009)
- Strategies to prevent hypertrophic scar formation: a review (2020)
- The Most Current Algorithms for the Treatment and Prevention of Hypertrophic Scars and Keloids, Plastic and Reconstructive Surgery (2021)
- Silicone sheets and new gels to treat hypertrophic scars and keloids: A short review (2020)
- The use of fluid silicone gels in the prevention and management of scars (2022)
- Topical Silicone Sheet Application in the Treatment of Hypertrophic Scars and Keloids (2016)
- Prevention and management of hypertrophic scars after laparoscopic surgery using silicone gel sheets (2022)
- An International e-Delphi Study on the Treatment of Keloids with Intralesional Corticosteroids (2024)
- Combined versus single treatment regimens for keloid therapy (2021)
- Treatment of hypertrophic scars and keloids using intralesional laser therapy (2020)
Reconstruction mammaire après cancer : cicatrisation et risques
Après une mastectomie, la reconstruction mammaire améliore l’image corporelle et la qualité de vie, mais le temps de la cicatrisation nécessite une attention particulière. La reconstruction qu’elle soit immédiate ou différée impose une surveillance et des décisions rapides en cas d’alerte. Cet article synthétise les repères clés pour les soignants experts : facteurs de risque, signes précoces et conduites à tenir en cas de troubles cicatriciels pour sécuriser le parcours.
Au sommaire
- Qu’est ce que la reconstruction mammaire ? Ses objectifs et le suivi
- Intervetion immédiate ou différée ?
- Quelles sont les techniques chirurgicales ? Prothèse, expandeur, lambeaux (DIEP)
- Quelle surveillance précoce pour les cicatrices ?
- Quelles sont les complications précoces des cicatrices ?
- Infections et implant
- Quelles sont les complications cutanées intermédiaires et tardives ?
- Quelles prévention effectuer et comment optimiser la période péri-opératoire ?
- Quels dispositifs pour améliorer l’aspect esthétique ?
- Radiothérapie et reconstruction mammaire : quel délai et quelle séquence adopter ?
- FAQ – Reconstruction mammaire & cicatrisation
- Références
Qu’est ce que la reconstruction mammaire ? Ses objectifs et le suivi
La reconstruction après cancer vise à restaurer forme et volume du sein après mastectomie, avec un impact attendu sur l’image corporelle et la qualité de vie.
La décision est partagée, s’inscrivant dans un parcours pluridisciplinaire de soins post-opératoires.
Le suivi post-mastectomie doit être expliqué : l’information doit être claire, nuancée et adaptée au projet thérapeutique.
Intervention immédiate ou différée ?
Deux stratégies sont possibles : immédiate (dans le même temps que la mastectomie) ou différée (après traitements adjuvants comme la chimiothérapie/radiothérapie ou l’optimisation des facteurs de risque).
Quelles sont les techniques chirurgicales après mastectomie ? Prothèse, expandeur, lambeaux (DIEP)
La reconstruction par implant comprend la reconstruction mammaire par prothèse (un temps) ou un protocole en deux temps avec
expandeur mammaire avant la prothèse définitive.
Les lambeaux autologues (dont DIEP) apportent du tissu vascularisé : Le tissu vivant prélevé chez la patiente (peau ± graisse, parfois muscle), est déplacé pour reconstruire le sein. Le lambeau conserve sa vascularisation. Il est soit relié par un pédicule intact (lambeau pédiculé), soit rebranché sur des vaisseaux du thorax en microchirurgie (lambeau libre, p. ex. DIEP). Objectif : apporter un volume et une couverture de bonne qualité, notamment en terrain irradié, sans implant.
Quelle surveillance précoce pour les cicatrices ?
Surveiller la cicatrice de mastectomie : couleur, chaleur, douleur, écoulement, tension cutanée.
La prise en charge des plis, zones de souffrance ou de tension cutanée doit suivre le protocole du chirurgien.
Le suivi de la cicatrice de mastectomie s’effectue en période précoce (J1–J15) puis jusqu’à stabilisation.
Quelles sont les complications cutanées précoces les plus fréquentes ?
Désunion nécessitant des pansements adaptés (alginates de calcium/hydrofibres/hydrocellulaires), suture dirigée ou cicatrisation dirigée selon la profondeur.
Nécrose cutanée : délimitation, soins locaux, débridement. Une reprise éventuelle est proposée si l’atteinte est profonde.
Sérome : ponctions itératives, prescription de vêtements compressifs, et prévention.
Hématome : évacuation chirurgicale si tension douloureuse.
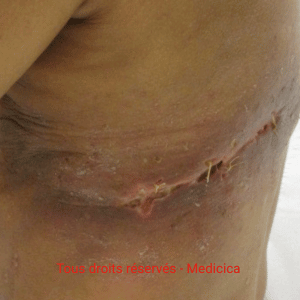
Infections et implant
Les tableaux superficiels nécessitent une antibiothérapie adaptée et des soins locaux.
Les pansements indiqués sont les alginates de calcium, pansement au DACC, pansements à l’Ag, hydrofibres, pansements superabsorbants. Les pansements occlusifs doivent être impérativement évités. Les solutions antibiofilms comme le PRONTOSAN ® ou l’OCTENIDINE ® peuvent être proposées. Dans ces circonstances, les soins locaux sont obligatoirement quotidiens.
En cas d’atteinte profonde autour d’un implant, un lavage chirurgical avec changement ou ablation peut être proposé selon le timing et les résultats bactériologiques.
Le sauvetage d’implant reste envisageable dans certaines situations précoces et contrôlées.
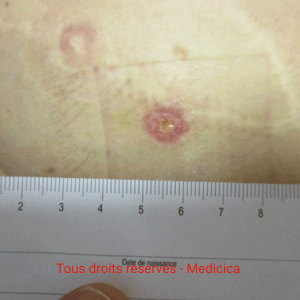
Quelles sont les complications cutanées intermédiaires et tardives les plus fréquentes ?
Intermédiaires (1–6 mois). Douleurs et troubles sensitifs (hypo-/dysesthésies), nécrose graisseuse, anomalies de forme ou de volume,
asymétries ou ptose du sein reconstruit. Après lambeau autologue, surveiller le site donneur (défaut de fermeture, protrusion/hernie abdominale selon le type de lambeau).
Adaptation de la prise en charge : antalgiques, rééducation, retouches limitées si gênes fonctionnelles ou esthétiques invalidantes.
Tardives (> 6 mois) :
cicatrices pathologiques : hypertrophiques et chéloïdes sur cicatrices de mastectomie ou de site donneur. Prévention : réduction des tensions, prise en charge des facteurs locaux. Place des dispositifs siliconés et pressothérapie selon protocole. Infiltrations, retouches prudentes, techniques adjuvantes selon disponibilité.
En cas d’implant : coque périprothétique (douleur, rétraction, déformation), ondulations, malposition/rotation. Rupture et sérome tardif ou infection à bas bruit. La conduite est graduée : imagerie si doute, ponction/culture pour un liquide tardif.
Discussion de capsulotomie/capsulectomie, changement ou ablation d’implant selon le cas.
En pratique : informer les patientes des signes d’alerte et des délais de consultation. Suivi à moyen et long terme, surtout en terrain irradié ou en cas de facteurs de risque.
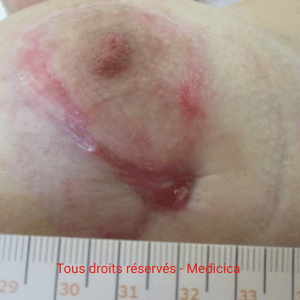
Quelles prévention effectuer et comment optimiser la période péri-opératoire ?
Plusieurs facteurs bien identifiés majorent le risque de complications : tabac, IMC élevé, diabète, âge, antécédents de radiothérapie.
La prévention comprend sevrage tabagique, contrôle glycémique, optimisation nutritionnelle et un bon timing opératoire.
Au bloc opératoire : atraumatisme tissulaire, hémostase, drainage raisonné, prophylaxie selon protocole.
Quels dispositifs pour améliorer l’aspect esthétique ?
Des dispositifs de symétrisation peuvent être proposés, comme le mamelon silicone cancer. Ces choix doivent rester cohérents avec le projet chirurgical et les attentes de la patiente.
Radiothérapie et reconstruction mammaire : quel délai et quelle séquence adopter ?
La radiothérapie post-mastectomie impose une reconstruction différée. Elle est de 12 à 18 mois après la fin de la radiothérapie, permettant aux tissus de récupérer de la fibrose induite.
Paradoxalement, les complications sont minimales dans les 3 premiers mois ou après 24 mois, la période de 3 à 6 mois présentant le risque le plus élevé (près de la moitié des complications).
Trois séquences thérapeutiques sont possibles : la reconstruction différée (taux de complications le plus faible), l’utilisation d’expandeurs avec échange tardif après radiothérapie (compromis acceptable), ou la séquence inversée avec radiothérapie néoadjuvante (protocole émergent), c’est à dire après reconstruction.
La radiothérapie après reconstruction entraîne des complications spécifiques : contracture capsulaire, infections majorées, et échec reconstructif dans 1/4 des cas pour les implants. Elle altère aussi la qualité de la peau compliquant l’insertion d’un implant ou la réalisation d’un lambeau. Les autres complications sont : retard de cicatrisation, nécrose cutanée, fibrose et cicatrice hypertrophique.
L’échange expandeur-implant définitif doit attendre au minimum 6 mois après radiothérapie pour minimiser les désunions cicatricielles. Les évolutions vers la radiothérapie hypofractionnée (16 / 25 séances) n’augmentent pas les complications et améliorent la tolérance, optimisant ainsi la séquence thérapeutique.
FAQ – Reconstruction mammaire & cicatrisation
Quelle reconstruction après une mastectomie ?
Trois approches principales : implant (pré- ou sous-pectoral, souvent avec matrice), lambeau autologue (DIEP, grand dorsal, PAP…) et lipofilling (souvent en complément). Le choix dépend de la qualité tissulaire (irradiation ?), des comorbidités (IMC, diabète, tabac), des préférences de la patiente, et de l’expertise de l’équipe. En terrain irradié, on privilégie souvent le lambeau pour apporter des tissus bien vascularisés.
Quel est le temps moyen de cicatrisation après une reconstruction, et comment optimiser la guérison ?
Peau/plaie : environ 2–3 semaines pour l’épithélialisation (si fermeture primaire), 4–6 semaines pour une cicatrice « mûre » initialement. Tissus profonds : remodelage 6–12 semaines (implant), 8–12 semaines (lambeau) avec consolidation progressive. Optimiser : arrêt du tabac ≥4 sem avant/après, contrôle glycémique, apport protéique suffisant, gestion des volumes (expanseur), prévention sérome/hématome (drains, compression), pansements adaptés, Thérapie par pression négative si risque élevé.
Quels sont les facteurs de risque de retard de cicatrisation et comment les prévenir ?
Principaux facteurs : radiothérapie, tabagisme, IMC ≥ 30, diabète mal équilibré, dénutrition, grandes tensions cutanées, durée opératoire longue. Prévenir : sevrage tabagique, optimisation pondérale et nutritionnelle, planning opératoire (immédiate vs différée), technique atraumatique, évaluation per-op de la perfusion (ICG, thermographie), antibioprophylaxie, drains, TPN ciblée.
Quelles sont les complications locales à surveiller ?
Précoces (J0–J30) : hématome, sérome, infection du site opératoire, désunion/déhiscence, nécrose cutanée ou du complexe aréolo-mamelonnaire, souffrance de lambeau. Tardives : extrusion d’implant, nécrose graisseuse, cicatrices hypertrophiques/chéloïdes, coque capsulaire (implant), complications du site donneur (sérome, hernie abdominale, faiblesse dorsale).
Quels soins locaux et crèmes utiliser pour améliorer souplesse et apparence des cicatrices, et quand ?
Après fermeture complète (en général à 2–3 semaines) : hygiène douce, hydratation quotidienne (crème neutre non parfumée), gel/feuilles de silicone 12–24 h/24 pendant 8–12 sem pour prévenir l’hypertrophie, massages cicatriciels progressifs dès que non douloureux (≈3–4 sem). Photoprotection SPF 50+ ≥ 6 mois. En cas d’irritation adhésifs : privilégier les interfaces siliconées.
Quel est l’impact d’une radiothérapie ou chimiothérapie sur la cicatrisation, et le moment optimal pour la reconstruction ?
Radiothérapie : fragilise la peau (fibrose, ischémie), augmentation nécrose, désunion, infection et coque capsulaire avec implant. Le plus sûr : mastectomie → (éventuel expanseur) → radiothérapie → reconstruction différée après 6–12 mois. Chimiothérapie : possible retard de cicatrisation ; on espace la chirurgie de reconstruction d’environ 4–6 sem après la dernière cure.
Quels exercices de kinésithérapie sont recommandés ?
Phase précoce (J2–J10) : respiration diaphragmatique, mobilisation douce main-coude-épaule sous la douleur, posture/scapula. Phase intermédiaire (sem 3–6) : amplitude progressive (bâton, mur), glissements scapulaires, étirements pectoraux doux, auto-drainage si œdème. Phase tardive (après 6 sem) : renforcement léger ceinture scapulaire, proprioception. Adapter si lambeau abdominal (gainage progressif, éviter efforts 6–8 sem).
Quelle surveillance post-opératoire, à quelle fréquence, et quels signes d’alerte ?
Rythme type : J7–J10 (pansements, retrait fils/drains), 1 mois, 3 mois, 6 mois, 12 mois, puis annuel. Alerte urgente : fièvre >38 °C, sein rouge et douloureux, écoulement purulent, désunion qui s’élargit, apparition d’une zone violacée/noirâtre (ischémie), douleur brutale avec tuméfaction (hématome), implant visible/palpable sous peau amincie, décoloration/refroidissement d’un lambeau.
Quelles complications de cicatrisation sont les plus fréquentes après reconstruction ?
Infection du site opératoire, désunion/déhiscence, nécrose cutanée, sérome, hématome. Complications majeures plus rares : exposition/perte d’implant, perte partielle de lambeau.
Quelles sont les séquelles possibles d’un lambeau ?
Sein : nécrose graisseuse (nodules), irrégularités de contour. Site donneur : cicatrice visible, sérome, paresthésies, faiblesse pariétale/hernies (abdominal), réduction de force/raideur (grand dorsal), douleur chronique.
Combien de temps après une mastectomie peut-on reconstruire ?
Immédiate (au temps de la mastectomie) si oncologiquement et techniquement favorable. Différée : en pratique 3–6 mois après fin de la chirurgie/chemo simple ; après radiothérapie, attendre classiquement 6–12 mois selon l’état tissulaire.
Radiothérapie : risques spécifiques et adaptation de la surveillance ?
Augmentation désunion/nécrose, infection, coque capsulaire (implant), nécrose graisseuse (lambeau). Surveillance rapprochée les 6–8 premières semaines : contrôle de la perfusion cutanée (couleur, chaleur, douleur), détection précoce des collections, bas seuil pour reprise/lavage. En prévention : différer la reconstruction, préférer lambeau si peau très irradiée, utiliser TPN sur incisions à risque, évaluer la perfusion per-op (ICG/thermographie).
Références
- Somogyi RB, Ziolkowski N, Osman F, et al. Reconstruction mammaire : aperçu actualisé à l’intention des médecins de soins primaires. Can Fam Physician. 2018;64(6):e255-e264. Lien
- Ministère des Solidarités et de la Santé / HAS / INCa / ANSM, etc. Information patients – Reconstruction mammaire (Point sur…, 2017). Lien
- RoseUp Association. Reconstruction mammaire : le vrai du faux. Lien
- Centre Léon Bérard. Reconstruction mammaire après cancer : nos experts répondent à vos questions. Lien
- Medscape (FR). Reconstruction mammaire après mastectomie : précoce ou tardive ? Lien
- Cleveland Clinic (Consult QD). Breast Reconstruction Complications Not Linked to Breast Cancer Recurrence. Lien
- Ooi ASH, Song DH. Reducing infection risk in implant-based breast-reconstruction surgery. BCTT. Lien
- Chang EI, Liu J. Mastectomy skin flap necrosis: challenges and solutions. Lien
- Potnuru P, Jonna S, Williams GW, et al. Cannabis Use Disorder and perioperative outcomes. JAMA Surg. 2023. Lien
- Outcome analysis of intraoperative angiography for postmastectomy breast reconstruction. Lien
- Assessment of mastectomy skin flaps for immediate reconstruction. Lien
- The influence of neoadjuvant chemotherapy on complications of breast reconstruction. Lien
- Centre Léon Bérard. « La reconstruction mammaire. » 2022-09-30. https://www.centreleonberard.fr/patient-proche/cancer-pris-en-charge/cancer-du-sein/reconstruction-mammaire
- Institut du Sein. « Reconstruction mammaire secondaire ou différée. » https://www.institut-du-sein.fr/reconstruction-mammaire-secondaire-ou-differee
- PubMed. « The Impact of Timing of Delayed Autologous Breast. » 2024-04-30. https://pubmed.ncbi.nlm.nih.gov/37751883/
- IFSEIN. « Reconstruction Mammaire Immédiate : la règle, pas l’exception. » 2017-01-06. https://www.ifsein.com/post/2017/01/07/reconstruction-mammaire-immediate-la-regle-pas-lexception
- MDPI. « Incidence and Risk Assessment of Capsular Contracture in Breast Cancer Patients following Post-Mastectomy Radiotherapy and Implant-Based Reconstruction. » 2023-12-31. https://www.mdpi.com/2072-6694/16/2/265

Aliments pour favoriser la cicatrisation après une chirurgie
Après chirurgie, l’organisme entre en hypercatabolisme, avec hausse des dépenses énergétiques, mobilisation des réserves et réorientation de la synthèse protéique. La nutrition post-opératoire devient un levier thérapeutique essentiel : apports protéiques adaptés, aliments riches en vitamines et oligo-éléments, correction des carences, et recours raisonné aux compléments nutritionnels. Ce guide propose aux infirmiers et médecins experts plaies-cicatrisation un référentiel opérationnel fondé sur les données récentes et les protocoles validés.
Pourquoi la cicatrisation dépend de l’alimentation et des vitamines
La chirurgie induit une réponse inflammatoire systémique avec activation neuroendocrinienne et mobilisation des réserves. Les besoins énergétiques augmentent jusqu’à 25–30 kcal/kg/j, tandis que la synthèse protéique se détourne des protéines structurelles au profit des protéines de phase aiguë. Le catabolisme musculaire s’accroît sous l’effet de cytokines (TNF-α, IL-1, IL-6). La dénutrition préopératoire constitue ainsi un facteur de risque majeur de complications : retard de cicatrisation, infections, perte musculaire, hospitalisation prolongée.
Alimentation : quels aliments pour favoriser la cicatrisation après chirurgie ?
Que manger après une opération ? Les meilleurs aliments pour la cicatrisation combinent un apport optimal en protéines, en vitamines pour cicatriser (notamment C, D, A, E, K, B) et en minéraux-clés (zinc, fer, cuivre, magnésium, sélénium). Cette nutrition post-opératoire s’intègre dans un régime post-opératoire structuré pour soutenir chaque phase de la réparation tissulaire.
Protéines : sources recommandées
Les protéines sont le socle de la cicatrisation : elles participent à la collagénogenèse, à la régénération cellulaire et au soutien immunitaire. Les études cliniques démontrent qu’un régime hyperprotéiné améliore la cicatrisation, en particulier chez les grands brûlés. Les sources recommandées :
- Animales : viandes maigres, poissons (dont poissons gras), œufs, produits laitiers.
- Végétales : légumineuses (lentilles, pois chiches), céréales complètes, tofu/soja.
Aliments riches en micronutriments essentiels
- Poissons gras : oméga-3 aux propriétés anti-inflammatoires.
- Légumes verts : épinards, brocoli, chou kale riches en vitamines et minéraux.
- Légumineuses : protéines, fer et zinc.
- Fruits frais (kiwis, agrumes, baies) : apport en vitamine C et antioxydants.
- Noix et graines (amandes, graines de chia) : magnésium et zinc.
Aliments à limiter
Voici les aliments à éviter pour la cicatrisation : limiter les sucres ajoutés, les graisses saturées et les aliments ultra-transformés, qui favorisent l’inflammation et manquent de nutriments essentiels. L’alcool interfère avec la synthèse protéique et l’absorption vitaminique.
Exemple d’assiette équilibrée
Exemple de menu cicatrisation :
- ¼ protéines maigres (poisson gras, volaille, légumineuses)
- ¼ céréales complètes (riz brun, quinoa)
- ½ légumes colorés riches en vitamines C et A (poivrons, épinards, carottes)
- 1 fruit riche en vitamine C (kiwi, agrumes)
- 1 source de lipides de qualité (huile d’olive, avocat, noix)
Ce modèle met en avant des aliments cicatrisation après opération faciles à intégrer au quotidien.
Protéines et régénération tissulaire
La reconstruction tissulaire requiert un apport protéique de 1,2 à 2,0 g/kg/j, selon le stress métabolique. Les protéines animales offrent un profil complet d’acides aminés et une biodisponibilité élevée, essentielles à la synthèse du collagène. Les protéines végétales, bien que nécessitant des associations (céréales + légumineuses), apportent fibres et composés bioactifs bénéfiques. L’association des deux optimise l’utilisation protéique.

Vitamines et cicatrisation : C, A, D, E, K, B6, B12, folates
Vitamine C
Cofacteur indispensable à l’hydroxylation de la proline et de la lysine, la vitamine C soutient la synthèse du collagène et stimule l’immunité. Une étude clinique a montré qu’une supplémentation de 500 mg deux fois par jour pendant 5 jours améliore la cicatrisation après chirurgie implantaire dentaire. Sources : poivron rouge (180 mg/100 g), kiwi (93 mg), brocoli (81 mg), agrumes (~53 mg). Recommandation : 3–4 fruits et 1 portion de légumes quotidiennement — des vitamines pour cicatriser à prioriser en post-opératoire.
Vitamine A
Régule la réponse inflammatoire, favorise la différenciation épithéliale et la synthèse du collagène. Une carence réduit l’épithélialisation et la formation du tissu de granulation. Sources : carottes, patates douces, épinards, œufs, foie.
Vitamine D
Via le récepteur nucléaire VDR, elle module l’immunité et stimule la production de peptides antimicrobiens (cathélicidine). L’insuffisance est associée à un retard de cicatrisation et à une réponse inflammatoire excessive. Une supplémentation préopératoire de plusieurs semaines est recommandée. Sources : exposition solaire, poissons gras, œufs, produits enrichis.
Vitamine E
Antioxydant majeur, elle protège contre le stress oxydatif mais des doses excessives peuvent inhiber la synthèse de collagène. Sources : noix, graines, épinards, avocats, huile d’olive.
Vitamine K
Essentielle à la coagulation sanguine. Une étude a montré que l’application topique améliore la cicatrisation dès le 4e jour, réduisant le temps de guérison moyen. Sources : légumes à feuilles vertes, brocoli, pois, haricots.
Vitamines B
Les vitamines B6, B12 et folates sont des cofacteurs essentiels des réactions enzymatiques liées à la cicatrisation et à la formation leucocytaire. La vitamine B9 est indispensable : une carence altère la production d’anticorps et augmente le risque infectieux. Sources : viandes, abats, légumineuses, légumes verts, céréales enrichies.
Oligo-éléments et minéraux : zinc, fer, cuivre, magnésium, sélénium
Zinc – les bienfaits : impliqué dans >300 réactions enzymatiques, division cellulaire, régénération tissulaire, immunité. Zinc cicatrisation plaie : un statut adéquat favorise l’épithélialisation et la défense antioxydante. Sources : fruits de mer, viande rouge, graines de citrouille, noix, produits laitiers. Une carence multiplie le risque de complications nutritionnelles.
Fer : essentiel au transport d’oxygène, corrige l’anémie qui retarde la cicatrisation. Sources : viande rouge, lentilles, épinards, céréales enrichies.
Cuivre : participe à la formation du collagène et aux défenses antioxydantes. Sources : foie de veau, crustacés, huîtres, noix, chocolat noir.
Magnésium : intervient dans plus de 300 réactions enzymatiques, synthèse protéique et immunité. Sources : noix, graines, légumes verts, céréales complètes.
Sélénium : antioxydant, protège contre les dommages oxydatifs. Sources : fruits de mer, viandes, noix du Brésil, graines, céréales complètes.
Tableau des aliments riches en vitamines et minéraux utiles à la cicatrisation
| Micronutriment | Rôle dans la cicatrisation | Sources alimentaires | Apports conseillés |
|---|---|---|---|
| Vitamine C | Synthèse du collagène, immunité, antioxydant | Kiwi (93 mg/100 g), poivron rouge (180 mg/100 g), agrumes (50–60 mg/100 g), brocoli (81 mg/100 g) | ≈ 100–200 mg/j en post-opératoire |
| Vitamine A | Épithélialisation, tissu de granulation, modulation de l’inflammation | Carotte, patate douce, épinards, foie, œufs | 700–900 µg/j |
| Vitamine D | Immunité, peptides antimicrobiens, cicatrisation osseuse | Poissons gras (saumon, sardine), œufs, produits enrichis, exposition solaire | 800–1000 UI/j (selon 25-OH D) |
| Vitamine E | Protection contre le stress oxydatif | Noix, amandes, graines, épinards, huile d’olive | 12–15 mg/j |
| Vitamine K | Coagulation, cicatrisation précoce | Légumes verts (kale, brocoli, épinards), pois, haricots | 90–120 µg/j |
| Vitamines B (B6, B12, B9) | Synthèse protéique/collagène, fonction immunitaire | Viandes/abats, légumineuses, céréales enrichies, légumes verts | B6 : 1,3–1,7 mg/j · B12 : 2,4 µg/j · B9 : 400 µg/j |
| Zinc | Division cellulaire, régénération tissulaire, immunité | Huîtres, viande rouge, graines de courge, noix, laitages | 8–11 mg/j |
| Fer | Transport d’oxygène, prévention de l’anémie | Viande rouge, lentilles, épinards, céréales enrichies | 8–18 mg/j |
| Cuivre | Formation du collagène, défense antioxydante | Foie, crustacés, huîtres, noix, chocolat noir | ≈ 0,9 mg/j |
| Magnésium | Synthèse protéique, fonction immunitaire | Noix, graines, légumes verts, céréales complètes | 300–400 mg/j |
| Sélénium | Antioxydant (glutathion peroxydase) | Noix du Brésil, fruits de mer, viandes, graines | ≈ 55 µg/j |
Suppléments nutritionnels post-opératoires : quand et comment
La supplémentation est indiquée si les apports alimentaires sont insuffisants ou en cas de carences avérées. Les compléments enrichis en arginine, vitamine C, vitamine A, zinc et sélénium sont recommandés pour les plaies complexes ou escarres stades III–IV.
Exemple validé : 2 capsules/j contenant vitamine C (500 mg), vitamine D (10 µg) et zinc (15 mg). Un complément cicatrisation de type CNO peut s’intégrer à une nutrition post-opératoire quand les apports restent <60 % des besoins.
Précautions : excès de vitamine C (diarrhées), A (toxicité hépatique, osseuse, visuelle), zinc (troubles digestifs, altération immunitaire). La prescription doit toujours être adaptée aux bilans biologiques.

Dénutrition et profils spécifiques (escarres, personne âgée)
La dénutrition est un facteur de risque majeur de complications post-opératoires (infections, retards de cicatrisation, perte musculaire). Elle est définie par un IMC <18,5 kg/m² (<21 si >70 ans), une perte de poids >=5% en 1 mois ou >=10% en 6 mois. Sa prévalence atteint 46,7% en chirurgie viscérale.
Escarres : la malnutrition favorise leur apparition et complique la cicatrisation. Prise en charge : CNO hyperprotéinés enrichis en arginine (ex. Cubitan®). L’arginine stimule l’immunité, améliore la vascularisation et favorise la synthèse de collagène.
Personne âgée : besoins spécifiques (réserves réduites, absorption altérée). Évaluation par IMC, albuminémie, préalbumine. Une albumine <35 g/L ralentit la cicatrisation. Stratégies : enrichissement des repas, fortification protéique, CNO spécialisés, surveillance rapprochée.
Surveillance nutritionnelle et suivi clinique
La surveillance débute par l’évaluation préopératoire via les scores NRS-2002 ou NUTRIC :
- NRS ≥3 : support nutritionnel indiqué.
- NUTRIC ≥5 : risque accru de complications.
En post-opératoire, si les apports <60% des besoins : assistance nutritionnelle dès 24 h pour patients à haut risque (grades 3–4) ou à partir du 7e jour pour grade 2.
Critères cliniques
- Perte de poids (≥5% en 1 mois ou ≥10% en 6 mois).
- État de cicatrisation.
- Survenue de complications infectieuses.
- Évaluation de la fonction musculaire.
Critères biologiques et outils
- Albumine >35 g/L, préalbumine >200 mg/L.
- CRP, dosages de vitamines (25-OH D, B12, folates).
- Bio-impédancemétrie, échographie musculaire.
- Calorimétrie indirecte pour ajuster les apports.
Conclusion
Une stratégie nutritionnelle personnalisée, intégrant protéines, vitamines et oligo-éléments, est un pilier de la cicatrisation post-opératoire. Les données récentes confirment l’efficacité de la correction des carences et d’un apport protéique adapté sur la réduction des complications et l’optimisation du rétablissement. Les professionnels de santé doivent s’appuyer sur un suivi clinique et biologique structuré, en particulier chez les personnes âgées et dénutries, et collaborer avec un spécialiste en nutrition clinique pour ajuster les interventions.
FAQ — Aliments pour favoriser la cicatrisation après une chirurgie
Faut-il éviter certains aliments (sucre, gras, alcool) pendant la convalescence ?
Oui. Les sucres rapides, les graisses saturées et l’alcool freinent la cicatrisation. Ils favorisent l’inflammation, perturbent la synthèse du collagène et diminuent l’absorption de micronutriments essentiels. L’alcool interfère aussi avec le métabolisme des protéines. Pendant la convalescence, privilégier des aliments frais et non transformés, riches en protéines maigres, légumes colorés, fruits frais et graisses de bonne qualité (huile d’olive, noix, avocat).
Les compléments alimentaires (vitamines C, D, zinc…) sont-ils vraiment utiles après une opération ?
Ils peuvent être utiles selon le contexte. Si l’alimentation couvre les besoins, ils ne sont pas systématiques. En revanche, chez un patient dénutri, âgé, immunodéprimé, porteur de plaies chroniques ou après une chirurgie lourde, la supplémentation (vitamine C, vitamine D, zinc, parfois arginine) améliore la cicatrisation et réduit le risque infectieux. Elle doit être guidée par les bilans biologiques pour éviter les surdosages.
L’alimentation peut-elle réduire le risque d’infection post-opératoire ?
Oui. Une alimentation riche en protéines, vitamine C, zinc et vitamine D renforce l’immunité et soutient la cicatrisation. Ces nutriments favorisent la production de collagène, la réponse leucocytaire et la défense antimicrobienne. À l’inverse, une alimentation déséquilibrée ou une dénutrition augmentent le risque infectieux en fragilisant la barrière cutanée et en ralentissant la réparation tissulaire.
Quels aliments ou habitudes alimentaires limiter pour réduire l’inflammation et les retards de guérison ?
Limiter les aliments ultra-transformés (riches en sucres ajoutés, graisses saturées, additifs) qui entretiennent l’inflammation et sont pauvres en micronutriments. Réduire l’alcool, les viandes grasses et les fritures. À privilégier : protéines maigres, céréales complètes, fruits et légumes frais, sources d’oméga-3 (poissons gras, noix).
Quel aliment pour accélérer la cicatrisation ?
Il n’existe pas d’aliment « magique », mais certains sont particulièrement utiles : poivron rouge et kiwi (vitamine C), poissons gras (oméga-3 et vitamine D), légumineuses (protéines, fer, zinc), noix et graines (magnésium, sélénium, vitamine E). Un menu équilibré combinant ces sources optimise la réparation tissulaire.
Quel complément alimentaire est recommandé pour la cicatrisation de la peau ?
Les formules les plus documentées associent protéines, vitamine C, vitamine D, zinc et arginine. Indications : plaies complexes, escarres stades III–IV, ou carences confirmées. Exemples : compléments nutritionnels oraux hyperprotéinés enrichis en micronutriments. Attention aux excès (vitamine A, zinc) : prescription adaptée et surveillance recommandées.
Que faire si je suis végétarien ou végétalien pour bien cicatriser ?
Assurer 1,2–2 g/kg/j de protéines en combinant légumineuses et céréales complètes (ex. : lentilles + riz). Supplémentation fréquente en vitamine B12 et parfois vitamine D. Fruits et légumes colorés, noix et graines apportent vitamine C, antioxydants, zinc et magnésium. Un suivi diététique aide à prévenir les carences et à ajuster les apports.
Quel est le rôle du cuivre et du zinc dans le processus de cicatrisation ?
Le zinc joue un rôle central dans la division cellulaire, la prolifération des kératinocytes et le soutien de l’immunité ; une carence augmente le risque de retard de cicatrisation. Le cuivre intervient dans la formation du collagène, l’angiogenèse et les défenses antioxydantes. Ces deux oligo-éléments sont indispensables à la réparation tissulaire et doivent être surveillés en cas de plaie chronique ou de dénutrition.
Quelle quantité de protéines faut-il consommer pour favoriser la réparation des tissus ?
Recommandations : 1,2 à 2,0 g/kg/j selon le type de chirurgie et l’état nutritionnel. Chez la personne âgée, dénutrie ou après chirurgie lourde, viser 1,5–2,0 g/kg/j. Répartir les apports sur la journée et associer sources animales et végétales pour optimiser le profil en acides aminés essentiels.
Quels nutriments (protéines, vitamines, minéraux) sont essentiels à la cicatrisation des plaies ?
Protéines (collagène, immunité), vitamines C (collagène) et A (épithélialisation), vitamine D (immunomodulation, peptides antimicrobiens), vitamine E (antioxydant), vitamine K (coagulation). Oligo-éléments : zinc, cuivre, fer, magnésium, sélénium pour la division cellulaire et la réparation osseuse et cutanée.
Quelle protéine est bonne pour la cicatrisation des plaies ?
Les deux familles sont complémentaires : protéines animales (œufs, poisson, volaille, produits laitiers) : profil complet et bonne biodisponibilité ; protéines végétales (légumineuses, soja, quinoa) : efficaces si combinées, riches en fibres et composés antioxydants. L’association des deux optimise la synthèse du collagène.
Combien de temps après une opération puis-je prendre de la vitamine C ?
La vitamine C peut être débutée dès la phase post-opératoire immédiate si l’alimentation ne couvre pas les besoins. Des protocoles montrent un bénéfice avec 500 mg deux fois par jour pendant 5 jours, avec amélioration dès la première semaine. Adapter aux comorbidités et au bilan biologique.
Est-ce que la vitamine E aide à la cicatrisation ?
Oui, son rôle antioxydant protège les cellules du stress oxydatif. Toutefois, des apports excessifs peuvent freiner la synthèse du collagène. Viser un apport modéré (environ 12–15 mg/j) via l’alimentation (noix, graines, épinards, huiles végétales).
La pommade à la vitamine A est-elle efficace pour la cicatrisation de la peau ?
La vitamine A favorise l’épithélialisation et le tissu de granulation. En usage topique, elle peut aider sur les plaies superficielles et certaines cicatrices. Elle ne remplace pas les soins standard de plaies et doit être utilisée avec prudence (risque d’irritation). Demander un avis médical en cas de doute.
La vitamine K est-elle bonne pour la cicatrisation des plaies ?
Oui. Indispensable à la coagulation, elle favorise la cicatrisation précoce. Des données suggèrent un bénéfice de l’application topique avec une réduction du temps moyen de guérison. Apports alimentaires : légumes verts, chou kale, brocoli, pois, haricots.
Pourquoi de la vitamine C après une opération ?
La vitamine C est un cofacteur essentiel de l’hydroxylation de la proline et de la lysine, indispensable à la synthèse du collagène. Elle soutient l’immunité et réduit le risque d’infection. Les besoins augmentent après chirurgie : une couverture adéquate accélère la formation de tissu cicatriciel et améliore la solidité des sutures.
Quand mettre de la vitamine E sur une cicatrice ?
Uniquement après fermeture complète de la plaie, jamais sur une plaie ouverte. L’application peut limiter l’hypertrophie cicatricielle et améliorer l’aspect esthétique. Procéder par essais prudents sur petite zone et arrêter en cas d’irritation. Avis médical recommandé si terrain à risque.
Quel est le rôle de la vitamine D dans la cicatrisation ?
La vitamine D module l’immunité via son récepteur (VDR) et favorise la production de peptides antimicrobiens (cathélicidine). Elle participe aussi à la cicatrisation osseuse. Un déficit est associé à des retards de cicatrisation et une inflammation excessive. Le dosage de la 25-OH vitamine D guide la correction.
Quelle est la meilleure vitamine pour la cicatrisation de la peau ?
Pas de « meilleure » unique. Un trio prioritaire : vitamine C (collagène, immunité), vitamine D (immunité, antimicrobiens), vitamine A (épithélialisation). La vitamine E (antioxydant) et la vitamine K (coagulation) contribuent également. L’équilibre global prime sur un nutriment isolé.
Quelle vitamine prendre après une opération ?
Selon le profil : vitamine C (collagène), vitamine D (immunité), vitamine A (épithélialisation), vitamines B (B6, B12, folates). Un bilan peut orienter la dose et la durée. En cas d’apports insuffisants, discuter aussi de compléments hyperprotéinés enrichis en zinc et arginine.
Quelles vitamines sont bonnes pour la cicatrisation de la peau ?
Les plus utiles : C, D, A, E, K, ainsi que B6, B12 et B9. Elles agissent en synergie pour stimuler la régénération, renforcer l’immunité et limiter l’inflammation. Les apports alimentaires variés restent la base.
Quelle alimentation spécifique recommander chez un patient diabétique, immunodéprimé ou âgé fragile ?
Diabétique : contrôle glycémique strict, limiter les sucres rapides, privilégier fibres et protéines maigres. Immunodéprimé : apports élevés en protéines, vitamine D, zinc, sélénium. Âgé fragile : enrichissement alimentaire, textures adaptées, compléments nutritionnels oraux si besoin et hydratation surveillée.
Quels protocoles alimentaires recommander en cas de plaies chroniques ou cicatrisation difficile ?
Recourir à des CNO hyperprotéinés enrichis en arginine, vitamine C et zinc. Évaluer et corriger les carences (vitamine D, fer, B12, folates, zinc). Approche pluridisciplinaire (médecin, diététicien, infirmier) et réévaluation régulière clinique/biologique.
Quels conseils nutritionnels donner à un patient opéré pour optimiser la cicatrisation ?
Augmenter l’apport protéique (1,2–2,0 g/kg/j), consommer quotidiennement fruits et légumes riches en vitamines C et A, privilégier poissons gras (oméga-3, vitamine D), assurer un apport en zinc, fer et magnésium, et limiter sucres, alcool et aliments ultra-transformés. Fractionner les apports si besoin.
Quels sont les signes cliniques ou biologiques d’un déficit nutritionnel ralentissant la cicatrisation ?
Cliniques : perte de poids >5 % en 1 mois (ou >10 % en 6 mois), fonte musculaire, escarres, fatigue. Biologiques : albumine <35 g/L, préalbumine <200 mg/L, CRP élevée, carences en vitamines (C, D, B12, folates), déficits en zinc ou fer.
Quelle stratégie mettre en place pour prévenir la dénutrition et ses conséquences sur la cicatrisation ?
Dépistage préopératoire (NRS-2002, NUTRIC), enrichissement des repas, suivi des apports. Si <60 % des besoins couverts : compléments nutritionnels oraux, voire nutrition entérale/parentérale selon la tolérance. Objectif : couvrir les besoins dès les 24 heures postopératoires chez les patients à haut risque.
Quels apports journaliers de protéines recommander selon l’âge, le type de chirurgie ou la pathologie ?
Adulte : 1,2–1,5 g/kg/j. Personne âgée ou chirurgie lourde : 1,5–2,0 g/kg/j. Brûlures et plaies chroniques : besoins souvent les plus élevés. Répartir sur la journée et associer sources animales et végétales.
Existe-t-il des recommandations officielles (HAS, PNNS, sociétés savantes) sur la nutrition et la cicatrisation postopératoire ?
Oui. HAS, ESPEN, SFNEP recommandent le dépistage systématique du risque nutritionnel, l’augmentation des apports protéiques, et l’usage de compléments enrichis (arginine, vitamine C, zinc) dans les plaies complexes ou escarres, avec suivi clinique et biologique.
Quand et comment surveiller les apports nutritionnels (outils de dépistage, bilans biologiques) chez un patient opéré ?
Outils : NRS-2002, NUTRIC. Biologie : albumine, préalbumine, CRP, 25-OH vitamine D, B12, folates, zinc. Clinique : poids, IMC, évolution des plaies et de la force musculaire. La surveillance débute avant l’intervention et se poursuit pendant toute la convalescence.
Sources / Références
- Perfect Health Solutions. (2024). Pourquoi se supplémenter en vitamine C après une opération.
- Ma Cicatrice. (2024). Les meilleurs aliments pour une bonne cicatrisation.
- Typology. (2024). Comment la vitamine K améliore la cicatrisation des plaies.
- Le Guide Santé. (2025). L’importance des protéines dans le régime post-chirurgical.
- Harmonie Santé. (2022). Comment l’alimentation peut-elle favoriser la cicatrisation.
- Santelog. (2025). Plaies : Quels nutriments, quelles vitamines pour mieux cicatriser.
- Milta. (2024). Une bonne alimentation pour accélérer la cicatrisation des plaies.
- ADRC of Brown County. (2025). Nutrition avant et après la chirurgie.
- ScienceDirect. (2020). Nutrition et cicatrisation.
- Université de Lille. (2024). Influence de la vitamine D dans le métabolisme osseux.
- BioGroup. (2024). L’importance des oligo-éléments pour la santé.
- Dr. Benhamou. Vitamine D pour la cicatrisation des plaies et des cicatrices.
- Santelog. (2020). Fracture de la hanche : Vitamine D, ni trop, ni trop peu.
- Cerballiance. (2024). Le rôle essentiel du zinc dans notre corps.
- EHESP. (2024). Nutrition clinique en réanimation : Vers une médecine personnalisée.
- AP-HP. (2014). Nutrition Péri-opératoire.
- PMC. (2018). Fréquence et déterminants de la dénutrition post-opératoire en chirurgie viscérale.
- Le Guide Santé. (2025). Comment éviter les carences nutritionnelles après une opération.
- FMC Gastro. (2025). Reconnaître et traiter la dénutrition en ambulatoire.
- Santé Forma Pro. (2025). Dénutrition chez la personne âgée : Quelles conséquences.
- Coloplast Professional. (2012). Nutrition & hydratation – Escarre.
- PMC. (2014). Immunonutrition: Role in Wound Healing and Tissue Regeneration.
- PubMed. (2009). Efficacy of vitamin supplementation in situations with wound healing disorders.
- Cerenut. (2022). Escarres – Mesures préventives – Prise en charge nutritionnelle.
- PubMed. (2019). Nutrition in wound healing: investigation of the molecular mechanisms.
- Hôpitaux de Saint-Maurice. (2008). Escarres – Collection Prévention.
- Nestlé Health Science. (2023). Les escarres : causes, symptôm
Dermite ocre : définition, symptômes, traitement et prévention de cette complication de l’insuffisance veineuse
Définition de la dermite ocre
La dermite ocre correspond à une hyperpigmentation brun-rouille des jambes secondaire à l’hyperpression veineuse chronique. Il s’agit d’un signe clinique de dermatite de stase (ou dermite de stase) et non d’une entité autonome. Dans la classification CEAP 2020 (classification internationale des maladies veineuses chroniques), elle relève du stade C4a (pigmentation et/ou eczéma) ; C4b = lipodermatosclérose/atrophie blanche, C4c = corona phlebectatica ; C6 = ulcère veineux actif.
Codage CIM-10 dermite ocre : Le codage le plus utilisé pour la dermite de stase/dermite ocre dans le contexte d’insuffisance veineuse est I87.2 – Insuffisance veineuse (chronique) (périphérique). Des codes I83.x s’ajoutent en cas de varices avec ulcère/inflammation.
Clinique et symptômes
Le diagnostic est clinique, dans un contexte d’insuffisance veineuse chronique connue ou suspectée. Les signes incluent : macules ou nappes brun-rouille péri-malléolaires, parfois confluentes avec extension ascendante ; prurit ou sensation de chaleur, parfois décrit par les patients comme des jambes qui grattent ; association possible à œdème, varicosités, ou eczéma de stase. Des descriptions fréquentes sont l’apparition de taches sur les jambes, parfois évoluant en tache rouge sur les jambes, ou en tache brune pied cheville et plaque rouge cheville en cas d’eczéma cheville associé.
Un écho-Doppler veineux est recommandé pour documenter le reflux ou l’obstruction.
Physiopathologie de la dermite ocre
L’hypertension veineuse entraîne l’extravasation des globules rouges hors des capillaires. Le fer contenu dans l’hémoglobine se dépose sous forme d’hémosidérine dans le derme, ce qui déclenche une réaction inflammatoire locale (stress oxydant, MMP) pouvant entraîner une fibrose dermo-hypodermique responsable de la lipodermatosclérose, de l’atrophie blanche et parfois d’angiodermite.
Causes principales
- Insuffisance veineuse chronique superficielle (reflux saphénien, perforantes) ou profonde (post-thrombotique, obstruction).
- Hyperpression fonctionnelle prolongée : station debout prolongée, obésité, multiparité, antécédents chirurgicaux/traumatiques veineux (en particulier hanche, genou, cheville).
Facteurs de risque
Âge avancé, surcharge pondérale, sédentarité, professions en orthostatisme, antécédents de TVP/TVS, prédisposition familiale, mobilité de cheville diminuée.
Diagnostics différentiels
- Eczéma de stase (C4a) : plaques érythémato-squameuses très prurigineuses.
- Dermatoses purpuriques pigmentées (maladie de Schamberg).
- Hyperpigmentation post-inflammatoire.
- Hémosidérose post-traumatique (sidérose iatrogène).
- Hémochromatose (pigmentation diffuse non localisée aux jambes).
- Vascularites (purpura palpable, nécroses).
Complications et évolution
La dermite ocre est un marqueur de gravité de l’insuffisance veineuse chronique. Elle augmente le risque d’ulcère veineux (C6), parfois décrit comme une plaie variqueuse. Le prurit est fréquent, les douleurs surviennent surtout en cas de sclérose cutanée ou d’ulcération. Des surinfections cutanées, des dermatites de contact et un œdème de stase peuvent compliquer l’évolution. Le pronostic dépend du traitement veineux et de l’adhésion à la compression.
Principes du traitement
1) Traitement veineux
- Compression médicale : bas, chaussettes ou bandages (20–40 mmHg). Toujours vérifier l’absence d’artériopathie par la mesure de l’IPS.
- Interventions veineuses : sclérothérapie, ablation thermique endoveineuse, MOCA, cyanoacrylate, chirurgie. Chez l’ulcéreux, l’ablation précoce du reflux accélère la cicatrisation.
2) Prise en charge cutanée
- Émollients quotidiens pour réparer la barrière cutanée.
- Dermocorticoïdes en cas d’eczéma de stase ou d’eczéma cheville.
- Antiseptiques dermite ocre / antibiotiques locaux uniquement si lésions érodées/surinfectées.
- Dépigmentants/chélateurs de fer : efficacité limitée.
- Topiques cuivre-zinc ou crème dermite ocre : effets prometteurs mais non confirmés.
- Lasers/photothérapie (Nd:YAG, alexandrite, IPL) : options expérimentales.
3) Mesures associées
Protection cutanée, hydratation, élévation des jambes, éviter le piétinement et l’orthostatisme prolongé, marche quotidienne et exercices de pompe du mollet, contrôle pondéral. Des approches alternatives comme certains « remèdes de grand-mère » pour la dermite ocre sont parfois évoquées mais ne sont pas validées scientifiquement.
Prévention et suivi
La prévention repose sur la compression au long cours, le suivi coordonné (médecin traitant, angiologue, infirmier, dermatologue si besoin). L’éducation du patient est essentielle pour la prévention de l’ulcère veineux, parfois confondu avec une plaie variqueuse montrant des lésions cutanées avancées.
Éducation thérapeutique (ETP)
L’adhésion à la contention est primordiale. Hygiène cutanée simple avec émollients, auto-surveillance des signes d’aggravation, activité physique régulière, gestion du poids.
Points clés à retenir
- La dermite ocre correspond au stade C4a de la classification CEAP.
- C’est un facteur de risque d’ulcère veineux et un marqueur de sévérité de l’IVC.
- La compression veineuse et le traitement étiologique sont essentiels.
- Les lasers et traitements dépigmentants restent expérimentaux.
FAQ Dermite ocre
Qu’est-ce que la dermite ocre ? (définition générale + « dermite ocre des jambes »)
La dermite ocre des jambes est une hyperpigmentation brun-rouille secondaire à l’hyperpression veineuse chronique. Elle reflète la sévérité de l’insuffisance veineuse et correspond au stade C4a de la classification CEAP.
Quels sont les signes cliniques précoces et évolutifs ?
Coloration brun-rouille péri-malléolaire s’étendant parfois à la jambe, jambes qui grattent, taches sur les jambes, ou plaque rouge cheville en cas d’eczéma associé ; la douleur est rare hors sclérose ou ulcère.
Comment différencier la dermite ocre, de l’eczéma de stase, l’hémosidérose, l’hyperpigmentation post-inflammatoire, l’hémochromatose, et le purpura ?
Dermite ocre : pigmentation ferrique liée à l’IVC. Eczéma de stase : prurit marqué et plaques inflammatoires. Hémosidérose post-traumatique : localisée. Hyperpigmentation post-inflammatoire : après dermatose. Hémochromatose : diffuse. Vascularites : purpura palpable.
Quel est le Code CIM-10 correspondant à la dermite ocre ?
I87.2 – Insuffisance veineuse (chronique) (périphérique), avec éventuellement I83.x en cas de varices compliquées.
Quelles sont les causes principales ?
IVC superficielle ou profonde, hyperpression prolongée (station debout, obésité, grossesses multiples).
Quel le mécanisme de dépôt d’hémosidérine, le rôle du fer et de l’inflammation ?
L’extravasation des hématies entraîne un dépôt d’hémosidérine riche en fer, déclenchant une inflammation et une fibrose locale.
Quels sont les facteurs de risque ?
Âge, obésité, sédentarité, antécédents de TVP/TVS et orthostatisme prolongé.
Quelle est la physiopathologie (microcirculation, inflammation chronique) ?
Hyperpression veineuse, altérations microcirculatoires, inflammation chronique conduisant à la lipodermatosclérose et à l’atrophie blanche.
Comment diagnostiquer en pratique clinique ?
Diagnostic clinique : pigmentation brun‑rouille péri‑malléolaire dans un contexte d’IVC.
Quels sont les examens utiles ?
Écho‑Doppler veineux pour objectiver le reflux et évaluer la sévérité ; bilan vasculaire selon contexte.
Scores ou protocoles standardisés éventuels ?
La classification CEAP est la référence pour stadifier la maladie veineuse chronique. La compression est le traitement principal.
Quels sont les diagnostics différentiels avec d’autres dermatoses pigmentées ?
À distinguer de l’eczéma de stase, de l’hémosidérose post‑traumatique, de l’hyperpigmentation post‑inflammatoire, de l’hémochromatose et des vascularites.
La dermite ocre est-elle grave ?
Pas grave en soi, mais marqueur de sévérité et facteur de risque d’ulcère.
La dermite ocre démange-t-elle ? Est-elle douloureuse ?
Prurit fréquent ; douleur rare hors sclérose ou ulcère.
Quels sont les risques d’évolution ?
Risque d’ulcère veineux, d’atrophie blanche, de lipodermatosclérose et de surinfections.
Quelles sont les urgences cliniques possibles ?
Plaie variqueuse infectée ou dermite de stase surinfectée : prise en charge rapide.
Quel est le Pronostic à long terme
Dépend du contrôle étiologique veineux et de l’adhésion à la compression.
Quelle est l’approche thérapeutique standard ?
Compression médicale + prise en charge étiologique veineuse.
Quel est le rôle de la compression élastique (types de dispositifs, indications) ?
Bas, chaussettes, bandes (20–40 mmHg) en première intention, après vérification de l’IPS.
Quels sont les traitements topiques possibles ?
Émollients, dermocorticoïdes en cas d’eczéma ; topiques cuivre‑zinc, dépigmentants/chélateurs de fer (efficacité limitée) ; antiseptiques uniquement en cas de surinfection.
Quelles sont les options de médecine interventionnelle ?
Sclérothérapie, ablation thermique, MOCA, cyanoacrylate, chirurgie selon indication (notamment en contexte d’ulcère).
Quelles innovations thérapeutiques ?
Lasers dépigmentants et photothérapie : options encore évaluées, données limitées.
Quelles sont les mesures complémentaires ?
Hydratation, élévation des jambes, activité physique, perte de poids, cures thermales.
Comment prévenir la progression vers l’ulcère ?
Compression, hygiène de vie, suivi régulier.
Quelles sont les mesures pour éviter la récidive ?
Compression quotidienne, contrôle pondéral, activité physique.
Quelle éducation du patient ?
Adhésion au port de compression, hygiène cutanée, auto‑surveillance.
Quel suivi à long terme ?
Suivi régulier par médecin, infirmier, angiologue et dermatologue si besoin.
Quand orienter vers un angiologue, dermatologue, phlébologue ?
En cas de doute diagnostique, d’ulcère ou de complications cutanées.
Coordination médecin généraliste – infirmier(ère) – spécialiste ?
Coordination indispensable pour la pose de la compression, le suivi cutané et la prise en charge globale.
Importance de l’éducation thérapeutique et du parcours de soins pluridisciplinaire ?
L’ETP est essentielle pour prévenir les ulcères et améliorer l’observance thérapeutique.
Références
- Lurie F, et al. The 2020 update of the CEAP classification system. J Vasc Surg Venous Lymphat Disord. 2020.
- Zegarra TI, et al. CEAP Classification of Venous Disorders. StatPearls. 2023.
- Yosipovitch G, et al. Stasis Dermatitis: Clinical presentation & management. Dermatol Ther (Heidelb). 2023.
- Attaran RR, et al. Chronic venous disease—skin changes. JSCAI. 2023.
- WHO ICD-10 CM. I87.2 – Venous insufficiency (chronic) (peripheral). 2025.
- EWMA. Compression therapy – Guidelines. 2023.
- Bernatchez SF, et al. Venous leg ulcers: assessment & compression. Wound Rep Reg. 2021.
- Gohel MS, et al. Early endovenous ablation in venous ulcers (EVRA). N Engl J Med. 2018.
- Heidemeyer K, et al. QS‑Nd:YAG lasers in cutaneous siderosis. Acta Derm Venereol. 2020.
- MSD Manual Professional Edition. Stasis dermatitis. 2025.
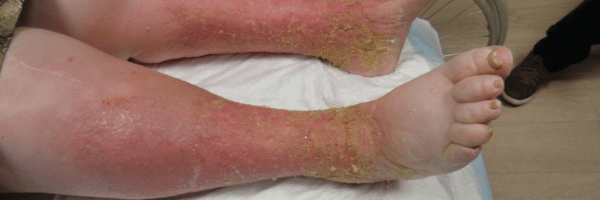
Dermite de stase : définition, diagnostic et prise en charge
La dermite de stase ou dermatite de stase (eczéma variqueux) est une complication cutanée fréquente de l’insuffisance veineuse chronique.
Elle associe eczéma prurigineux, hyperpigmentation par hémosidérine (souvent perçue comme des taches sur les jambes liées à la circulation),
œdème vespéral et risque évolutif vers l’ulcère veineux. La reconnaissance précoce et une prise en charge adaptée — notamment la
compression veineuse — préviennent les complications.
Physiopathologie
Hypertension veineuse chronique
Pression veineuse ambulatoire élevée sur insuffisance veineuse superficielle ou profonde (reflux valvulaire/obstruction)→ activation endothéliale, extravasation d’hématies, inflammation locale ;
terrain propice aux plaques rouges (érythème) péri-malléolaires et au développement de plaie variqueuse.
Inflammation et microangiopathie cutanée
Recrutement leucocytaire, perméabilité capillaire, dépôts d’hémosidérine auto-entretenant l’inflammation, spongiose, fibrose dermique, excès de MMP →
altération de la cicatrisation et ulcération.
Causes et facteurs de risque
Âge (progressif dès ~30 ans), sexe féminin (~3:1), multiparité/hormones, varices (C2+), syndrome post-thrombotique/TVP,
obésité, sédentarité, station debout prolongée, chaleur. Insuffisance cardiaque droite et HTA possibles.
Les antécédents d’ulcère ou de dermite ocre témoignent d’une stase installée.
Diagnostic clinique
Présentation et topographie
Eczéma chronique prurigineux des jambes : plaques rouges à la cheville mal délimitées, squameuses, xérose (sécheresse cutanée), dermite ocre.
Topographie péri-malléolaire interne ± dos du pied ; parfois extension vers la cuisse avec eczéma cheville /
eczéma variqueux jambes.
Signes associés : télangiectasies malléolaires, lipodermatosclérose (jambe “bouteille de champagne inversée”),
varices, œdème vespéral à godet. Le prurit des tibias/mollets est fréquent (requête “démangeaisons tibias mollets”).
Formes évolutives
- Aiguë : poussées érythémato-suintantes (vésicules/bulles), confusion possible avec dermite de contact ; contexte de jambe rouge et chaude chez certains patients. Sensation parfois de cuisson avec exsudats abondants.
- Chronique : hyperpigmentation persistante, poussées récidivantes ; plaques eczémateuses nummulaires possibles entre les cuisses.
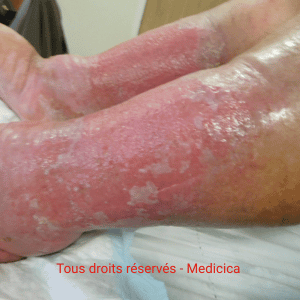
Diagnostics différentiels
- Cellulite/érysipèle : rougeur chaude, douloureuse, unilatérale, fièvre, évolution rapide.
- Dermatite de contact (allergique/irritative) : fréquente surajoutée (antiseptiques, antibiotiques topiques, excipients) → patch-tests à distance.
- Eczéma atopique, psoriasis, dermatoses purpuriques bénignes, dermopathie diabétique, xérose sévère.
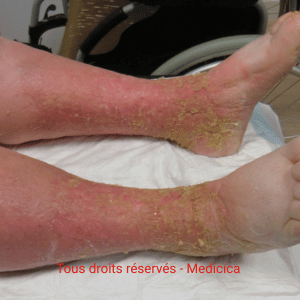
Examens complémentaires (Doppler, IPS, CEAP)
- Écho-Doppler veineux : cartographie, reflux/obstruction, orientation thérapeutique.
- Indice de pression systolique (IPS) : dépistage d’artériopathie (adapter la compression veineuse).
- Classification CEAP : C4a (pigmentation/eczéma), C4b (lipodermatosclérose / atrophie blanche), C5 (ulcère cicatrisé), C6 (ulcère actif).
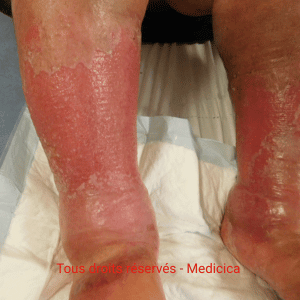
Complications et évolution
Ulcère veineux (aussi appelé ulcère variqueux), surinfection (impétiginisation, cellulite),
atrophie blanche, acroangiodermatite (pseudo-Kaposi), réaction id.
Rare : carcinome épidermoïde sur ulcère chronique (biopsie si cicatrisation lente/aspect suspect).
Prise en charge thérapeutique
Traitement étiologique (veineux)
Compression veineuse : bandages multicouches à la phase aiguë puis bas/chaussettes/collants classes 2–4 (~20 → >36 mmHg) au long cours ;
marche, surélévation. Eviter la station debout prolongée, le piétinement, les sources chaudes.
Traitement endoveineux (laser, radiofréquence) ou sclérothérapie mousse selon l’anatomie du reflux ;
phlébectomies ciblées. Veinotoniques : intérêt symptomatique modeste (appoint).
Renouvellement des bas/chaussettes/collants tous les 3 à 4 mois.
Traitement dermatologique (eczéma)
A la phase aiguë : dermocorticoïdes (classe II–III) en cures courtes, puis relais par émollients quotidiens. Si suintement : pansements adaptés (alginates de calcium/ hydrofibres/pansements superabsorbants)
Éviter topiques sensibilisants (néomycine, bacitracine, lanoline).
En cours d’évaluation : tacrolimus topique (hors AMM) ± doxycycline (données pilotes, avis spécialisé).
Gestion des complications
Antibiothérapie systémique si cellulite/ulcère infecté ; soins de plaies (nettoyage, débridement doux, antiseptiques selon contexte),
compression continue jusqu’à fermeture de la plaie variqueuse puis du lever au coucher.
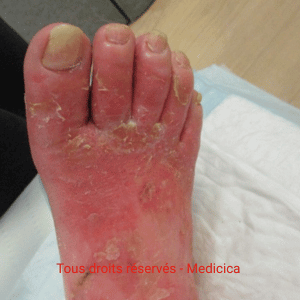
Prévention et suivi
Éducation thérapeutique et hygiène
Port quotidien des bas (renouvellement 3 à 4 mois), activité physique, surélévation, hydratation cutanée.
Conseils : douche tiède (éviter chaud), vêtements non irritants, éviter chaleur et orthostatisme prolongés.
Photos utile pour suivre l’évolution.
Calendrier de suivi
Formes C4/C5 stables : contrôle trimestriel → semestriel.
Ulcère actif : suivi rapproché jusqu’à fermeture, puis espacement.
Vérifier observance, technique d’enfilage, état/renouvellement des dispositifs.
Coordination interprofessionnelle
Médecin traitant, phlébologue/angiologue, dermatologue, infirmier(ère)s,
pharmacien (éducation à la compression, adaptation des dispositifs).
Aspects pratiques (CIM-10, CEAP)
- CIM-10 : I83.1 (varices MI avec inflammation = dermite de stase) ; I83.2 si ulcère + inflammation ; I87.2 (IVC périphérique) en complément selon contexte.
- Rappel CEAP : C4a pigmentation/eczéma ; C4b lipodermatosclérose/atrophie blanche ; C5 ulcère cicatrisé ; C6 ulcère actif.
Conclusion
La dermite de stase est un marqueur cutané d’hypertension veineuse chronique.
Une prise en charge précoce et multidisciplinaire, centrée sur la compression veineuse,
les soins dermatologiques simples et, si besoin, les gestes endoveineux, réduit le risque d’ulcère veineux et de récidive.
FAQ — Dermite de stase
Qu’est-ce qu’un œdème de stase ?
Œdème des membres inférieurs lié à une hypertension veineuse chronique (reflux/obstruction), secondaire à une insuffisance veineuse chronique (IVC). Il s’accentue en fin de journée (orthostatisme),
diminue au repos avec élévation des jambes et répond à la compression veineuse.
Qu’est-ce que la dermite de stase ?
Eczéma inflammatoire des jambes sur terrain d’IVC : plaques érythémato-squameuses prurigineuses, dermite ocre (dépôts d’hémosidérine), souvent péri-malléolaire, avec risque évolutif vers l’ulcère veineux.
Quelles sont les causes de la dermite de stase ?
La cause sous-jacente est l’hypertension veineuse chronique liée au reflux valvulaire et/ou à l’obstruction (varices, syndrome post-thrombotique). Facteurs favorisants : âge, sexe féminin, multiparité, obésité, station debout prolongée, chaleur.
Quelle est la cause la plus fréquente d’un œdème de stase de la cheville ?
L’insuffisance veineuse chronique (reflux veineux superficiel et/ou profond) est la cause la plus fréquente de l’œdème de stase péri-malléolaire.
Quels sont les symptômes de la dermite de stase des jambes ?
Prurit, plaques érythémato-squameuses mal délimitées, xérose, hyperpigmentation (dermite ocre), œdème vespéral, parfois lipodermatosclérose et télangiectasies malléolaires.
Quelles sont les complications possibles de la dermite de stase ?
Ulcère veineux, surinfection (impétiginisation, cellulite), atrophie blanche, acroangiodermatite (pseudo-Kaposi), et plus rarement carcinome épidermoïde (ulcère de Marjolin) sur ulcère chronique.
Comment faire la différence entre la cellulite et la dermatite de stase ?
Cellulite : rougeur chaude, douloureuse, unilatérale, fièvre et évolution rapide, réponse aux antibiotiques.
Dermite de stase : atteinte souvent bilatérale, prurigineuse, chronique, contexte d’IVC, œdème à godet,
amélioration sous compression/élévation.
Quel est le traitement pour la dermite de stase ?
Compression veineuse (bas classes 2–4 ou bandages) + mesures posturales (marche, surélévation) pour corriger l’hypertension veineuse ; soins cutanés : dermocorticoïdes (poussées), émollients en entretien, éviter topiques sensibilisants.
Correction du reflux par gestes endoveineux (laser/radiofréquence) ou sclérothérapie si indiqué.
Quelle crème est bonne pour la dermatite de stase veineuse ?
En phase inflammatoire : corticoïde topique (puissance modérée/forte, cure courte) sur l’eczéma.
En entretien : émollient neutre quotidien. Éviter antibiotiques/anesthésiques topiques (sensibilisation).
La correction veineuse repose d’abord sur la compression.
Quel est le code CIM-10 pour la dermite de stase ?
I83.1 (varices des membres inférieurs avec inflammation = eczéma/dermite de stase).
I83.2 si ulcère + inflammation. I87.2 (IVC périphérique) peut compléter selon le contexte local de codage.
Références
- Yosipovitch G. Stasis Dermatitis: An Overview of Its Clinical Presentation, Pathogenesis, and Management. Dermatol Ther (Heidelb). 2023.
- European Society for Vascular Surgery (ESVS). 2022 Clinical Practice Guidelines on Chronic Venous Disease of the Lower Limbs. 2022.
- NICE CG168. Varicose veins: diagnosis and management. 2013.
- Cochrane Review. Compression bandages or stockings vs no compression for venous leg ulcers. 2021.
- Cochrane Review. Compression therapy for preventing venous leg ulcers returning. 2024.
- Merck Manual – Professionnel (FR). Dermatite de stase. Mise à jour récente.
- American Academy of Dermatology (AAD). Stasis dermatitis: overview & treatment. 2020–.
- DermNet NZ. Venous eczema (stasis eczema). Mise à jour.
- Singh SK. Acroangiodermatitis (Pseudo-Kaposi). Review. 2014.
- Sîrbi AG, et al. Squamous cell carcinoma developed on chronic venous leg ulcer. Rom J Morphol Embryol. 2015.
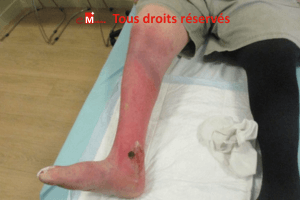
Lipodermatosclérose : définition, physiopathologie et prise en charge
La Lipodermatosclérose est une forme avancée d’insuffisance veineuse chronique associant une hyperpression veineuse, une stase veineuse et une fibrose cutanée ; elle peut se compliquer d’un ulcère à fond scléreux. Ce guide synthétique détaille les mécanismes, les signes cliniques (dermite ocre, atrophie blanche, eczéma variqueux), les limites de la compression et les protocoles infirmiers pour accélérer la cicatrisation.
Définition de la lipodermatosclérose
La lipodermatosclérose est une inflammation du tissu adipeux sous cutané (panniculite) et du derme entraînant une fibrose dermo-hypodermique du tiers inférieur de jambe. Elle correspond à la classe CEAP C4b de l’insuffisance veineuse chronique (IVC) et évolue sur plusieurs années de stase sanguine persistante.
Physiopathologie : stase et hyperpression veineuse
L’hyperpression veineuse prolongée déclenche :
- Une activation leucocytaire → cytokines pro-fibrotiques (IL-1, TNF-α).
- Destruction de l’hypoderme de jambe et de derme puis constitution de fibrose
- Raréfaction micro-vasculaire ⇒ hypoxie tissulaire avec atrophie blanche
- eczéma de stase, dermite de stase.
Le cercle vicieux « œdème → fibrose → retour veineux aggravé » explique l’apparition de l’ulcère veineux à fond scléreux.
Epidémiologie
Environ 10% des patients atteints d’insuffisance veineuse chronique développeront une lipodermatosclérose. Une ulcération secondaire survient chez environ 13% des patients.
Diagnostic & signes cliniques
Tableau typique :
- Dermite ocre de jambe (dépôts d’hémosidérine).
- Atrophie blanche jambe : zones parcheminées, avasculaires.
- Induration circonférentielle – avec chevilles en « bouteille de champagne inversée ».
- Doppler : reflux ou obstacle, pression veineuse > 90 mmHg.
- Au toucher, la peau est dure et on ne peut pas la plisser.
- peau rouge : dermo-hypodermite chronique peut être associée
Insuffisance veineuse profonde vs superficielle : quelles répercussions ?
Maladies veineuses profondes (syndrome post-thrombotique) et superficielles (reflux saphénien) partagent la même conséquence : stase et lipodermatosclérose. L’écho-Doppler cartographie les deux systèmes pour guider une éventuelle ablation endoveineuse ou la reperméabilisation profonde.
Traitement de la lipodermatosclérose
- Mesures d’hygiène : repos jambes surélevées 2 à 3 heures par jour, marche régulière, perte de poids, surélévation des pieds du lit (10 à 20 cm) , éviter la station debout prolongée et le piétinement.
- Compression élastique 30-40 mmHg ou systèmes inélastiques.
- Médicaments : pentoxifylline, flavonoïdes.
- Correction étiologique si possible : laser ou radiofréquence pour reflux superficiel ; angioplastie/ou stenting si obstruction profonde.
- Gestion de la peau périlésionnelle : émollients + dermocorticoïdes pour dermatite de stase.
Evolution et complications
Sans correction de l’insuffisance veineuse chronique, la lipodermatosclérose progresse vers une fibrose cutanéo-tendineuse, une atrophie blanche, un eczéma de stase et surtout un ulcère veineux récidivant.
La présence de lipodermatosclérose autour d’un ulcère est un facteur pronostique majeur de retard de cicatrisation et de récidive.
Une sclérose importante au niveau de la cheville, peut entrainer une raideur voire une ankylose de cheville. Cela entraine une limitation du retour veineux.
Ulcère veineux à fond scléreux : une gestion complexe
La sclérose se définit comme un développement anormal du tissu conjonctif entraînant une altération de la structure de la peau avec peu de cellules et peu de vaisseaux. La conséquence est un durcissement du fond de la plaie et des tissus environnants ainsi qu’une perte d’élasticité de la peau.
La sclérose est synonyme de fibrose. On parle alors d‘ulcère à fond « fibreux » ou « scléreux ». On peut lire aussi parfois ulcère « fibro-scléreux ».
Il y a souvent une inflammation chronique de la peau périphérique (dermite chronique ou dermo-hypodermite chronique) il peut y avoir aussi une atrophie (raréfaction des cellules avec aspect blanc = atrophie blanche).
La cicatrisation est souvent plus lente qu’un ulcère veineux standard. Cela vient du fait de la présence de peu de cellules et de la vascularisation insuffisante. Il faut donc en informer le patient et ne pas se décourager.
Le traitement de l’ulcères scléreux
Soins de base
Le fond fibreux de l’ulcère peut être pris pour de la fibrine mais en passant la curette, on retrouve une sensation de dureté de crissement comme de la pierre. Le fond saigne très vite.
Parfois on observe quelques zones rouges témoin de la présence de quelques vaisseaux ou de rares bourgeons.
La plaie est souvent très douloureuse notamment lors de la détersion.
Elle a tendance à s’agrandir en cas de lavage ou de détersion trop agressive ou de pansement inadapté : elle se rapproche du cas des plaies pathergiques comme l‘angiodermite nécrotique ou le pyoderma gangrenosum
lavage très doux sans frotter et limiter la détersion au maximum.
On peut utiliser des anesthésiants locaux comme la LIDOCAINE en gel et au besoin des antalgiques par voie orale en complément lors des soins.
Compression comme décrite plus haut.
Pansements possibles en première intention
- Hydrofibre/alginate (exsudats + à ++).
- Mousse silicone (exsudat ±).
Pansements à éviter : hydrogels et pansements hydro-balancés (macération bordure), TPN, pansements trop adhérents.
Traitements de seconde intention
La greffe cutanée est utile pour relancer la cicatrisation en particulier le bourgeonnement même si la prise de greffe n’est pas toujours bonne.
L’électrostimulation peut permettre de favoriser le bourgeonnement, diminuer la douleur avec la possibilité d’effecteur une greffe de couverture de qualité dans un second temps après avoir obtenu un bourgeonnement homogène de la plaie.
Le gel de PRP peut favoriser le bourgeonnement et l’antalgie en protégeant bien les bords
La matrice dermique acellulaire, intermédiaire entre un pansement et une greffe, peut relancer la cicatrisation.
La luminothérapie LED ou laser infrarouge peut contribuer à stimuler les cellules de la cicatrisation.
Compression et tissus scléreux : limites & solutions
La fibrose rend la peau « incompressible » ; la pression interface mesurée reste < 40 mmHg malgré un bandage classique. Solutions :
- Dispositifs de bandage multicouche avec bandes à extension courte
- Compression pneumatique intermittente si œdème persistant.
Suivi infirmier
Tracer la surface de plaie, photos régulières, éduquer à l’élévation des jambes, éviter station debout prolongée, surveiller l’oedème de stase.

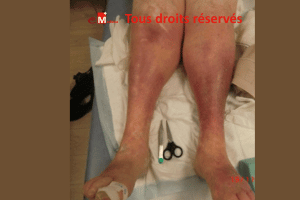
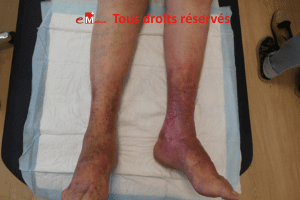
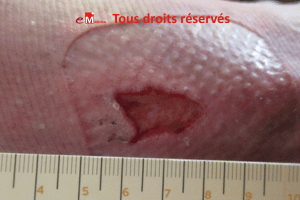
FAQ – Lipodermatosclérose
Qu’est-ce que la lipodermatosclérose ?
Il s’agit d’une panniculite inflammatoire avec fibrose cutanée due à une insuffisance veineuse chronique sévère et une stase veineuse prolongée.
La lipodermatosclérose est-elle grave ?
Oui : elle prédispose à l’ulcère veineux scléreux, douloureux et long à cicatriser, et signale souvent une maladie veineuse avancée.
Quelle est la cause principale de la lipodermatosclérose ?
Une hyperpression veineuse chronique : reflux saphénien non traité, syndrome post-thrombotique, obstruction iliaque, ou combinaison des deux.
La compression peut-elle devenir inefficace ?
Oui. Quand les tissus deviennent très durs, la pression se transmet mal. Utilisez des bandes inélastiques et complétez éventuellement avec des séances de compression pneumatique intermittentes.
Comment traiter la lipodermatosclérose ?
Compression adaptée, traitement étiologique veineux, soins cutanés pour dermite ocre et eczéma de stase, exercices veineux et perte de poids.
Sources

Zoom sur les Médicaments qui Accélèrent la Cicatrisation
💊💊💊 Explorer les médicaments clés qui favorisent la cicatrisation. De l’importance des vitamines à l’effet du sulfate ferreux et des hormones, découvrez comment optimiser la guérison des plaies. 💊💊💊
Dans la prise en charge des plaies, l’attention se porte fréquemment sur les médicaments susceptibles de ralentir la cicatrisation. Cependant, il est tout aussi intéressant de mettre en lumière ceux qui peuvent, à l’inverse, favoriser ce processus.
Comme mentionné dans mes précédentes publications, les vitamines A, C et E jouent un rôle essentiel dans la cicatrisation des plaies. Néanmoins, il existe également des médicaments spécifiques ayant une influence positive sur cette dernière.
Le fer
Le sulfate ferreux, par exemple, fournit le fer nécessaire à la synthèse de l’hémoglobine, essentielle au transport de l’oxygène dans le sang. Une oxygénation adéquate est un facteur clé dans le processus de cicatrisation des plaies. Ainsi, dans le traitement de l’anémie, l’apport en fer peut avoir un impact significatif.
Les hormones thyroïdiennes
Les hormones thyroïdiennes régulent le métabolisme et influencent également la cicatrisation. Une hypothyroïdie peut, par exemple, entraver la réparation des tissus suite à une blessure. Corriger ce déséquilibre peut donc contribuer à une meilleure cicatrisation.
L’insuline
L’insuline est aussi étudiée pour son rôle potentiel dans ce domaine, particulièrement chez les patients diabétiques, où une gestion efficace du diabète peut nettement améliorer la cicatrisation.
Les hormones de croissance
Les hormones de croissance, quant à elles, ont un effet direct sur la réparation et la régénération des tissus. Leur administration peut ainsi stimuler la cicatrisation des plaies en cas de déficience.
Les Cyclines ?
En outre, les cyclines, grâce à leur effet anti-inflammatoire, peuvent également jouer un rôle dans la stimulation de la cicatrisation.
Conclusion
Il est donc essentiel d’effectuer des évaluations standards, incluant un hémogramme complet et un dosage de la TSH, chez les patients présentant des plaies chroniques. Cela permet de détecter d’éventuelles anomalies simples telles que l’anémie ferriprive ou l’hypothyroïdie, et d’adopter une approche thérapeutique adaptée pour favoriser la cicatrisation.
Cette perspective enrichit notre compréhension de la gestion optimale des plaies et souligne l’importance d’une approche globale dans le traitement des patients.

Quand l’Alcool Empêche de Guérir : Étude de l’Impact de l’Alcoolisme sur la Cicatrisation
Explorez l’impact de l’alcoolisme sur la cicatrisation : quels en sont les risques ? Plongez dans un cas clinique révélateur pour mieux comprendre cette problématique.
Impact local
L’alcoolisme est un facteur bien connu affectant négativement le processus de cicatrisation, en particulier durant les phases critiques d’inflammation et de prolifération cellulaire. Il augmente également de manière significative le risque d’infections des plaies. Il peut conduire à des cicatrices de moindre qualité ou à des ulcérations chroniques.
Les mécanismes sous-jacents sont multiples :
- Une baisse des défenses immunitaires est directement liée à la consommation d’alcool. Même une exposition brève peut induire une réduction de la réponse immunitaire, notamment en supprimant la libération de médiateurs clés de l’inflammation tels que les cytokines.
- L’alcoolisme chronique peut réduire la synthèse de collagène et l’angiogenèse, entravant ainsi l’apport de nutriments et d’oxygène nécessaire à une cicatrisation efficace.
Un cas clinique révélateur :
J’ai rencontré un patient souffrant d’un petit ulcère malléolaire résistant à la guérison depuis plus de deux ans malgré toutes les précautions et traitements appropriés. Ce cas complexe d’insuffisance veino-lymphatique n’était pas aggravé par des facteurs évidents, les bilans complémentaires n’apportant aucune réponse. Cependant, une consommation d’alcool cachée et occasionnelle mais intense durant certains week-ends entravait sa cicatrisation.
Ce n’est qu’à travers des discussions régulières et un hasard révélateur que cette consommation a été découverte. À l’arrêt complet de l’alcool, la plaie a rapidement cicatrisé.
Conclusion
Même une consommation occasionnelle et intense d’alcool peut induire un retard significatif de cicatrisation. Cette expérience souligne l’importance d’une évaluation complète et d’une communication ouverte avec les patients pour une prise en charge efficace.

En quoi l’Obésité Retarde-t-elle la Cicatrisation ?
Imaginez-vous en pleine randonnée en montagne. Vous marchez depuis des heures et soudain, vous vous blessez. Une petite plaie apparaît, suffisamment importante pour nécessiter des soins. Mais au lieu de se refermer rapidement comme à l’habitude, elle tarde à cicatriser. Pour les personnes obèses, ce scénario est malheureusement trop fréquent. Pourquoi cela arrive-t-il ?
La Diminution de la Perfusion Sanguine 🩸
L’excès de tissu adipeux agit comme une barrière, comprimant les vaisseaux sanguins. Les nutriments et l’oxygène peinent à atteindre leur destination. La plaie, en manque de ces ressources vitales, mettra bien plus de temps à guérir.
L’Inflammation Chronique 🔥
L’obésité s’accompagne souvent d’une inflammation systémique, comme un feu qui couve en permanence. Ce feu perturbe la réponse immunitaire, prolonge la phase inflammatoire de la cicatrisation et empêche la progression vers la phase de prolifération cellulaire et de maturation des tissus.
L’Altération de la Production de Collagène
Le collagène, cette protéine structurelle qui rend nos cicatrices solides, est en défaut chez les personnes obèses. Elle entraîne des cicatrices plus faibles et plus fragiles, plus susceptibles de se rouvrir ou de se dégrader.
L’Augmentation du Risque d’Infection 🦠
L’excès de poids crée un terrain fertile pour les bactéries. La peau, plus humide et avec une fonction immunitaire altérée, devient un terrain propice aux infections. Ces infections ralentissent encore plus la cicatrisation.
Le Diabète de Type 2 🍬
L’obésité est souvent le prélude au diabète de type 2. L’hyperglycémie chronique associée perturbe la production de collagène et la fonction des cellules immunitaires, retardant la cicatrisation et augmentant le risque de complications comme les infections et les ulcères chroniques.
L’Immobilité et les Soins de la Plaie
Le poids excessif limite souvent la mobilité, rendant les soins des plaies plus difficiles. Imaginez essayer de traiter une plaie difficile à atteindre, chaque mouvement étant un effort. L’immobilité peut également provoquer des escarres, ajoutant une couche de complication.
Les Études et Données Scientifiques
De nombreuses études ont révélé ces impacts.
Par exemple, « Diabetes Care » a démontré que les patients obèses diabétiques cicatrisaient beaucoup plus lentement que leurs homologues non obèses et non diabétiques.
« Advances in Wound Care » a aussi mis en lumière que l’excès de tissu adipeux entrave la formation de nouveaux vaisseaux sanguins, essentiels à la cicatrisation.
Conclusion
L’obésité, c’est comme marcher avec un poids supplémentaire dans une randonnée déjà difficile. Elle retarde la guérison, augmente le risque de complications et nécessite une attention particulière. Une approche multidisciplinaire est essentielle pour aider ces patients à retrouver une meilleure santé et une cicatrisation plus efficace.

Quelle est l’influence des troubles thyroïdiens sur la cicatrisation ?
Les troubles thyroïdiens influencent la cicatrisation en modifiant le métabolisme cellulaire et la qualité des tissus. L’hyperthyroïdie peut accélérer la guérison mais fragiliser les cicatrices, tandis que l’hypothyroïdie ralentit la réparation et favorise des cicatrices plus épaisses.
Le dysfonctionnement thyroïdien peut avoir un impact significatif sur la cicatrisation et la qualité des cicatrices.
Hyperthyroïdie
L’hyperthyroïdie, caractérisée par une production excessive d’hormones thyroïdiennes, peut :
- Accélérer le métabolisme cellulaire 🏃♂️, favorisant ainsi la cicatrisation, mais rendant les tissus plus fragiles et augmentant le risque de complications telles que les déchirures et les infections.
- Altérer la synthèse du collagène, entraînant des cicatrices de moindre qualité, plus fragiles et plus susceptibles de se déchirer.
- Augmenter la sudation et la température corporelle, provoquant une déshydratation des tissus, ralentissant le processus de cicatrisation et augmentant le risque d’infection.
Hypothyroïdie
L’hypothyroïdie, caractérisée par une production insuffisante d’hormones thyroïdiennes, peut :
- Ralentir le métabolisme cellulaire, retardant ainsi le processus de cicatrisation.
- Altérer la vascularisation des tissus, réduisant l’apport en nutriments et en oxygène nécessaires à la réparation tissulaire, ce qui ralentit également la cicatrisation.
- Modifier la composition du tissu conjonctif, favorisant la formation de cicatrices chéloïdes ou hypertrophiques.
Il est important de souligner que l’impact des troubles thyroïdiens sur la cicatrisation dépend de facteurs individuels tels que la sévérité de la maladie, la durée et l’efficacité du traitement pour rétablir un équilibre hormonal, l’état général du patient et les comorbidités associées.
Recherche actuelle
Actuellement, des recherches sont menées pour évaluer si l’application topique d’hormones thyroïdiennes pourrait stimuler la cicatrisation des plaies.
Combien de temps met une plaie profonde à cicatriser ? Guide professionnel complet
Le temps de cicatrisation d’une plaie profonde dépend surtout de sa surface et du terrain/âge, davantage que de la profondeur isolée. Plus la plaie est large et ancienne, plus la fermeture est lente, quel que soit son volume.
Étapes et délais : étape cicatrisation plaie
La cicatrisation cutanée normale suit quatre phases successives et chevauchantes :
- Phase vasculaire (hémostase) : formation du caillot et arrêt du saignement, en quelques minutes (≈ 8 min chez un sujet sans trouble de coagulation ni anticoagulant).
- Phase inflammatoire : 24–48 h (peut s’étendre quelques jours selon le contexte).
- Phase proliférative : bourgeonnement plaie (tissu de granulation rouge vif), contraction et épidermisation/épithélialisation à partir des berges.
- Phase de maturation : remodelage collagénique prolongé ; l’aspect « définitif » d’une cicatrice survient vers 12–18 mois (notamment après brûlure).
Ce que montrent les études modernes :
- L’âge ralentit la cicatrisation (inflammation prolongée, stress oxydant accru).
- La surface initiale et l’ancienneté de la plaie sont des déterminants majeurs des délais ; la profondeur est moins prédictive en pratique clinique.
Chronologie et chronicité : quand une plaie aiguë devient chronique ?
- Une plaie aiguë bien prise en charge diminue régulièrement de taille.
- Si après 6 semaines aucune amélioration n’est visible, la plaie est considérée comme chronique et doit être réévaluée (étiologie : ulcère veineux, pression/ischémie, pied diabétique…).
- Trajectoire attendue (ordre de grandeur clinique) : –20 à –30 % de surface toutes les ~3 semaines. Des repères validés selon l’étiologie : ≥30–50 % à 4 semaines prédit une forte probabilité de cicatrisation à 12 semaines ; en deçà, le risque d’échec augmente et un changement de stratégie s’impose.
- Après 3 mois, les chances de fermeture complète chutent nettement ; dans plusieurs cohortes, ~30 % des DFU/pressions et ~45 % des VLU seulement sont cicatrisés à 12 semaines malgré soins optimaux.
Facteurs influençant la vitesse de cicatrisation
Localisation : tronc, membres supérieurs et visage cicatrisent en général plus vite (vascularisation riche, moindres contraintes mécaniques). Le talon est particulièrement lent (pression/ischémie, PAD fréquente) et présente des taux d’échec plus élevés.
Terrain & hygiène de vie : âge, tabagisme, diabète, dénutrition, artériopathie, insuffisance veineuse, corticoïdes/immunosuppresseurs, faible observance sont les principaux facteurs de retard de cicatrisation.
Type de plaie :
- Plaie chirurgicale (fermeture primaire) : 14–21 jours pour l’épidermisation initiale selon site et tension → temps de cicatrisation d’une plaie chirurgicale.
- Plaie traumatique (seconde intention) : objectif ≤ 6 semaines si faible surface et prise en charge optimale.
- Ulcères veineux/pressions/pied diabétique : tendance à la chronicisation, surtout si > 4–6 semaines sans réduction de surface.
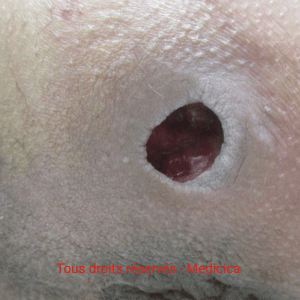
Évaluation et traitement : TIME & Wound Hygiene
Un bilan précis et étiologique est indispensable (insuffisance veineuse, hyperpression localisée, ischémie, infection/biofilm, dénutrition…).
Les pratiques actuelles s’articulent autour de :
- Modèle TIME (Tissue, Infection/Inflammation, Moisture, Edge) : préparation du lit de la plaie, contrôle de l’infection/inflammation, équilibre hydrique, stimulation du rebord.
- ou plus récemment le Wound Hygiene (2020–2022) : protocole systématique à chaque changement de pansement : détersion mécanique régulière (le plus tôt possible, dans la 1ᵉʳe semaine), nettoyage lit/péri‑lésionnel, refashioning des berges, et stratégies anti‑biofilm.
Choix des pansements (selon aspect/exsudat) :
- Plaie profonde : souvent très exsudative / plaie qui suinte : de type absorbant (alginate/fibres, super‑absorbants, hydrofibres), avec changements initiaux quotidiens puis espacés.
- Plaie plus superficielle/modérément exsudative : hydrocellulaires (mousses) ou interfaces non adhérentes, visant le milieu humide.
- Phase d’épidermisation/épithélialisation : pansements peu absorbants et protecteurs, espacement des soins.
Dispositifs complémentaires :
- Décharge systématique des ulcères plantaires diabétiques (plâtre de contact total ou dispositif équivalent non amovible en première intention).
- Contention veineuse adaptée (VLU).
- NPWT, greffes/substituts cutanés selon indications.
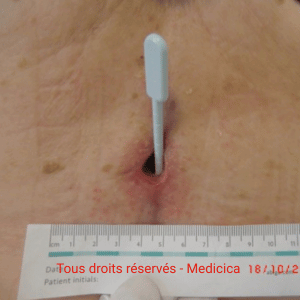
Suivi : mesure objective & critères d’alerte
- Mesurer à intervalles réguliers (photo + planimétrie) ; viser –20/–30 % de surface toutes les 3 semaines.
- Stagnation/aggravation → re‑bilan étiologique, rechercher infection/biofilm, ischémie, friction/pression, déséquilibre métabolique, défaut d’observance.
- Signes infectieux à surveiller. Exemples : douleur croissante, exsudat abondant, odeur, changement de couleur, aggravation rapide.
- Réévaluation spécialisée si absence d’évolution après 1 mois de soins adaptés.
Ce que nous enseignent les études
- Observations historiques (Carrel, Lecomte du Nouÿ, A. Lumière) :
- Vitesse de cicatrisation inversement corrélée à la surface ; non linéaire : rapide en granulation, plus lente en épithélialisation.
- Les petites plaies ferment nettement plus vite que les grandes.
- Au‑delà de ~150 cm², l’âge influence peu la vitesse ; recours à une greffe souvent nécessaire. Ces lois historiques ont ouvert la voie aux modèles modernes et restent utiles pour penser la trajectoire de cicatrisation, sans remplacer les recommandations actuelles.
- Études récentes : confirment que l’ancienneté, la surface et la localisation (ex. talon) sont des prédicteurs majeurs du délai et du risque d’échec.
Prédire le temps de cicatrisation : modèles pratiques
- Modèle de Lecomte du Nouÿ : courbe exponentielle décrivant la réduction de surface au cours du temps ; utile pour comparer le réel à l’attendu.
- Méthode d’Auguste Lumière (empirique, clinique) : mesurer régulièrement (p. ex. tous les 15 jours) la largeur maximale de la plaie une fois la détersion efficace.
Exemple chiffré :
– 15 déc. : largeur = 30 mm
– 30 déc. : largeur = 20 mm → vitesse = 0,6 mm/j
→ Temps prévisionnel pour fermer une plaie de 20 mm ≈ 33 jours → cicatrisation attendue ~31 janv.
À retenir : ces modèles aident à anticiper et objectiver l’évolution ; ils n’exonèrent pas d’une réévaluation rapide si la trajectoire déraille (<30–50 % à 4 semaines selon l’étiologie).
Conclusion
La durée de cicatrisation d’une plaie profonde dépend avant tout de sa surface, de son ancienneté et du terrain. Une plaie récente, bien évaluée (étiologie) et soignée précocement (TIME + Wound Hygiene, contrôle étiologique, décharge/stratégies spécifiques) a de fortes chances d’évoluer favorablement en quelques semaines. À l’inverse, une plaie chronique ou mal surveillée voit ses délais nettement allongés ; un suivi précoce, rigoureux et personnalisé reste la clé.
FAQ
1. Combien de temps met une plaie profonde à cicatriser ?
Cela dépend surtout de la surface, de l’ancienneté et du terrain du patient. Une plaie récente et bien prise en charge évolue en quelques semaines, tandis qu’une plaie chronique peut durer plusieurs mois.
2. Quelles sont les différentes étapes de la cicatrisation et combien de temps dure chacune ?
- Phase vasculaire (hémostase) : quelques minutes.
- Phase inflammatoire : 24 à 48 heures.
- Phase proliférative : apparition du tissu de granulation et début d’épithélialisation pendant plusieurs jours à semaines.
- Phase de maturation : remodelage cicatriciel sur 12 à 18 mois.
3. Quand peut-on considérer qu’une cicatrice est définitive ?
Au terme de la phase de maturation, soit après 12 à 18 mois.
4. Quelle est la partie du corps qui cicatrise le moins vite ?
Le talon est la zone la plus lente (pression et ischémie locales fréquentes).
5. Combien de temps faut-il pour qu’une croûte tombe ?
La croûte se détache spontanément lors de l’épithélialisation. Le délai varie selon la surface et l’équilibre hydrique de la plaie. Il ne faut pas l’arracher car cela entraîne un retard de cicatrisation et un risque de cicatrice pathologique.
6. Quelle est la durée moyenne de cicatrisation d’une plaie profonde selon l’âge ou l’état de santé ?
La vitesse diminue avec l’âge et les comorbidités (diabète, dénutrition, tabagisme, pathologies vasculaires). Chez un sujet âgé ou fragilisé, le délai est significativement prolongé.
7. Quelle est la durée type de cicatrisation selon la profondeur ou le type de plaie ?
- Plaie chirurgicale : 14–21 jours.
- Plaie traumatique : ≤ 6 semaines.
- Plaie chronique (ulcère, escarre, pied diabétique) : souvent > 3 mois sans prise en charge spécifique.
8. Temps cicatrisation coupure doigt / temps de cicatrisation d’une plaie profonde doigt :
Cela dépend de la surface, de la mobilisation (immobilisation/attelles si besoin), du contrôle de l’humidité et du risque d’infection. Le doigt cicatrise bien grâce à sa vascularisation riche, mais la contrainte mécanique peut ralentir l’épithélialisation.
9. Temps de cicatrisation point de suture :
Varie selon la localisation et la tension cutanée ; l’ablation est protocolisée par le chirurgien. La cicatrisation plaie chirurgicale suit les mêmes phases que toute plaie cutanée.
10. Temps de cicatrisation griffure visage / temps cicatrisation plaie visage :
Le visage cicatrise plus vite (vascularisation importante), avec un suivi cicatriciel prolongé pour optimiser la maturation (12–18 mois).
11. Délai pour suturer une plaie :
Généralement dans les six heures. Mais décision médicale selon l’âge de la lésion, son degré de contamination, la localisation (ex. visage), le risque ischémique et l’état général. Objectif : restaurer l’anatomie, réduire l’infection et optimiser la cicatrisation.
12. Plaie peau arrachée (skin tear) :
Haut risque de chronicisation ; privilégier une détersion douce, une ré‑apposition si possible, protection des berges et panssements adaptés favorisant un milieu humide.
13. Comment accélérer la cicatrisation d’une plaie profonde ?
En assurant un contrôle étiologique, un milieu humide, une détersion régulière, une bonne observance (décharge, contention) et un suivi rapproché.
14. Comment faire cicatriser une plaie profonde rapidement ?
Appliquer le modèle TIME et le concept de Wound Hygiene : détersion précoce, pansements adaptés à l’exsudat, prise en charge du biofilm, dispositifs complémentaires selon le type de plaie.
15. Quels facteurs peuvent retarder la cicatrisation ?
Âge avancé, tabac, diabète, dénutrition, insuffisance veineuse ou artérielle, corticothérapie/immunosuppresseurs, mauvaise observance.
16. Quels facteurs de risque faut-il identifier et quantifier ?
Les principaux sont : dénutrition, pathologies vasculaires, diabète, âge, traitements immunosuppresseurs et manque d’adhésion du patient aux soins.
17. Comment évaluer la profondeur, la taille et le type d’une plaie ?
Par un bilan clinique précis incluant mesure régulière (planimétrie, photos), analyse du lit de la plaie (tissu nécrotique, fibrine, bourgeonnement) et de la peau péri-lésionnelle.
18. Comment distinguer une plaie aiguë d’une plaie chronique ?
Une plaie aiguë régresse de façon régulière. Après 6 semaines sans amélioration, elle est considérée comme chronique.
19. Comment nettoyer correctement une plaie profonde ?
L’article indique la nécessité d’une détersion mécanique régulière et d’un nettoyage soigneux à chaque changement de pansement.
22. Quels soins ou produits sont recommandés pour une plaie profonde ?
Des panssements absorbants (alginate, hydrofibres, super-absorbants) pour les plaies exsudatives, des hydrocellulaires pour les plaies superficielles, et des pansements protecteurs en phase d’épithélialisation.
23. Comment choisir le pansement adapté ?
Selon l’aspect, le niveau d’exsudat et la phase de cicatrisation (prolifération vs épithélialisation).
24. À quelle fréquence changer un pansement sur une plaie profonde ?
Initialement tous les jours, puis espacement progressif selon l’évolution et le type de pansement.
26. Quand utiliser des produits topiques spécifiques ou des thérapies avancées ?
Selon indications : NPWT, greffes ou substituts cutanés en cas de plaies complexes ou stagnantes.
27. Comment accompagner le patient dans l’hygiène de vie ?
Éducation thérapeutique centrée sur l’observance, la décharge, la contention, la nutrition et l’arrêt du tabac.
28. Comment savoir si la cicatrisation se déroule normalement ?
On attend une diminution de 20–30 % de la surface toutes les 3 semaines.
29. Quels sont les signes normaux et anormaux ?
Normaux : régression progressive, bourgeonnement rouge vif, formation d’épithélium.
Anormaux : stagnation, aggravation, bourgeonnement terne, nécrose.
30. Quels sont les signes d’infection ? Quand consulter ?
Douleur croissante, exsudat abondant, odeur, changement de couleur, aggravation rapide. Consultation si absence d’évolution après 1 mois de soins adaptés.
31. Quand faut-il s’inquiéter ou consulter ?
Si la plaie n’évolue pas favorablement après 1 mois ou en cas de signes infectieux.
32. Quels sont les indicateurs de cicatrisation normale ou pathologique ?
Réduction régulière de surface ; stagnation ou aggravation sont des indicateurs pathologiques.
33. Quels critères permettent d’ajuster le traitement ?
Évolution de la surface, aspect du lit de la plaie, contrôle de l’exsudat, signes d’infection.
34. Peut-on prévoir la fin de la cicatrisation ?
Oui, grâce aux modèles de Lecomte du Nouÿ ou de Lumière, en comparant la vitesse réelle de fermeture à une courbe attendue.
36. Quels protocoles de surveillance permettent d’anticiper une infection ?
Surveillance régulière avec mesure, photos, recherche de douleur, exsudat, odeur, aggravation. Application systématique du concept de Wound Hygiene.
37. Quand référer un patient à un spécialiste ?
En cas d’absence d’évolution après 1 mois de soins optimisés, ou devant une plaie complexe/chronique nécessitant greffe, décharge spécialisée ou évaluation chirurgicale.
39. Plaie peau arrachée (skin tear) ?
Haut risque de chronicisation ; privilégier détersion douce, ré‑apposition si possible, protection des berges et panssements favorisant un milieu humide.
Références
- Wallace HA, et al. Wound Healing Phases. StatPearls ; mise à jour 2023. Lien : https://www.ncbi.nlm.nih.gov/books/NBK470443/
- Glynn E, et al. Wound Healing: A Comprehensive Review. Plast Reconstr Surg Glob Open 2021;9:e2427. Lien : https://pmc.ncbi.nlm.nih.gov/articles/PMC8432991/
- Loddo I, et al. Aging and Wound Healing of the Skin. Biomedicines 2022;10:2819. Lien : https://pmc.ncbi.nlm.nih.gov/articles/PMC9784880/
- Marston WA, et al. Baseline factors affecting closure of venous leg ulcers. J Vasc Surg Venous Lymphat Disord 2017. Lien : https://www.jvsvenous.org/article/S2213-333X(17)30351-7/fulltext
- Fife CE, et al. The Wound Healing Index for Predicting VLU Healing. Adv Wound Care 2019. Lien : https://pmc.ncbi.nlm.nih.gov/articles/PMC6940587/
- Cho SK, et al. Model to Predict Healing of Chronic Wounds. Adv Wound Care 2020;9(10):602–611. Lien : https://pmc.ncbi.nlm.nih.gov/articles/PMC7522633/
- Bossert J, et al. Educational interventions in VLU. Int Wound J 2022;19:1867–1881. Lien : https://pmc.ncbi.nlm.nih.gov/articles/PMC10088831/
- Harries RL, et al. Wound bed preparation – TIME update. Int Wound J 2016;13(S3):17–22. Lien : https://pmc.ncbi.nlm.nih.gov/articles/PMC7949772/
- Atkin L, et al. Defying hard‑to‑heal wounds: Wound Hygiene. J Wound Care 2020;29(Sup3b):S1–S26. Lien : https://www.magonlinelibrary.com/doi/full/10.12968/jowc.2020.29.Sup3b.S1
- Atkin L, et al. Embedding Wound Hygiene… J Wound Care 2022;31(Sup4a):S1–S26. Lien : https://www.magonlinelibrary.com/doi/full/10.12968/jowc.2022.31.Sup4a.S1
- Bowers S, Franco E. Chronic Wounds: Evaluation and Management. Am Fam Physician 2020;101:159–166. Lien : https://www.aafp.org/pubs/afp/issues/2020/0201/p159.html
- Bus SA, et al. (IWGDF) Offloading guideline 2023. Diabetes Metab Res Rev 2024 (publié en ligne 2023). Lien : https://iwgdfguidelines.org/wp-content/uploads/2023/07/IWGDF-2023-06-Offloading-Guideline.pdf
- Rivolo M, et al. Heel Pressure Injuries: Consensus. Int Wound J 2020;17:701–711. Lien : https://pmc.ncbi.nlm.nih.gov/articles/PMC7155923/
- Le Linn Y, et al. Ischaemic heel ulcers outcomes post‑revascularisation. Ann Vasc Surg 2020. Lien : https://pmc.ncbi.nlm.nih.gov/articles/PMC7949176/
- Walker RM, et al. Foam dressings for pressure ulcers. Cochrane 2017. Lien : https://pmc.ncbi.nlm.nih.gov/articles/PMC6485618/
- Britto EJ, et al. Wound Dressings. StatPearls ; mise à jour 2024. Lien : https://www.ncbi.nlm.nih.gov/books/NBK470199/
- Ngo QC, et al. Computerised prediction of healing for VLUs. Sci Rep 2022;12:17551. Lien : https://www.nature.com/articles/s41598-022-20835-y
- RCH Melbourne Wound assessment & management guideline. 2023. Lien : https://www.rch.org.au/rchcpg/hospital_clinical_guideline_index/Wound_assessment_and_management/
- Wounds‑UK A five‑level model for wound analysis (réf. Lecomte du Nouÿ). 2016. Lien : https://wounds-uk.com/wp-content/uploads/2023/02/d3a4c3332d96b6a16ad527528556de95.pdf
Note historique : Les lois de Carrel, Lecomte du Nouÿ et Auguste Lumière datent du début du XXᵉ siècle ; elles ne se substituent pas aux recommandations récentes ci‑dessus.
Plaie chronique : quand demander un avis médical ?
La gestion des plaies peut parfois être délicate, notamment lorsqu’elles ne guérissent pas dans un délai habituel. Il est crucial de savoir à quel moment consulter un professionnel de santé pour obtenir un avis médical. Voici les principaux points à considérer :
La localisation
Certaines localisations des plaies nécessitent une attention particulière. Même si une plaie semble superficielle, elle peut nécessiter un avis médical, notamment :
- Toute plaie située sur la main, en raison de la complexité de cette zone.
- Les plaies profondes qui atteignent des structures comme l’os, les tendons, les muscles, les vaisseaux sanguins ou les nerfs.
- Les plaies persistantes sur des zones inhabituelles comme la tête, le cou, le visage, les membres supérieurs ou le tronc.
- Toute plaie avec exposition de matériel (ex. matériel chirurgical ou prothèse).
- Les brûlures sur des zones fonctionnelles ou esthétiques, qui peuvent compromettre la fonction ou l’apparence.
Le contexte
Le contexte dans lequel la plaie est apparue joue également un rôle majeur dans la nécessité de consulter un médecin :
- Les plaies multiples qui ne cicatrisent pas chez un patient jeune.
- Les plaies extensives survenant après un traumatisme.
- Les plaies apparues après un retour de voyage, notamment en provenance de pays exotiques.
- Toute brûlure, même petite ou superficielle, qui ne cicatrise pas après trois semaines.
- Les plaies du pied chez une personne diabétique, qui sont particulièrement à risque.
Toute plaie douloureuse nécessite également une évaluation. - Toute plaie associée à de la fièvre, un signe d’infection sous-jacente.
- Les plaies survenant suite à une morsure animale.
La notion de temps
La durée pendant laquelle une plaie persiste est un indicateur clé :
- Une plaie présente depuis plus de six semaines sans soins infirmiers doit susciter l’inquiétude.
- L’absence d’amélioration d’une plaie après un mois de soins infirmiers bien conduits doit également inciter à consulter.
- Une dégradation brutale de la plaie ou une progression rapide nécessite une prise en charge immédiate.
L’aspect de la plaie
L’aspect visuel de la plaie est souvent révélateur de sa gravité :
- Une plaie recouverte d’une plaque noire ou nécrosée, en particulier sur un membre inférieur, nécessite une attention particulière.
- Les plaies multiples recouvertes d’une plaque noire ou présentant une nécrose (fond noir) doivent également être surveillées de près.
- Les plaies qui bourgeonnent excessivement, prenant un aspect de « chou-fleur », peuvent indiquer une anomalie dans le processus de cicatrisation.
- Toute plaie d’aspect atypique ou « bizarre » dans sa forme ou ses bordures nécessite une évaluation par un professionnel de santé.
Si vous avez des questions ou des doutes concernant une plaie qui tarde à guérir, n’hésitez pas à me contacter via la messagerie e-medicica.

Hyperbourgeonnement : une clé inattendue pour certaines plaies ?
🌼 🌼 🌼Découvrez le rôle des pansements induisant l’hyperbourgeonnement dans la cicatrisation. Apprenez comment les dermocorticoïdes modèrent ce phénomène et accélèrent l’épidermisation des plaies difficiles, tout en surveillant les risques associés🌼 🌼 🌼
Dans le domaine de la cicatrisation, certains pansements, notamment ceux à base de carboxyméthylcellulose (CMC) (la plupart des hydrogels et certains hydrofibres), ainsi que les tulles gras, sont reconnus pour induire un hyperbourgeonnement. Il est important de noter que cet effet est fréquent et peut se manifester de façon imprévisible.
L’hyperbourgeonnement, bien qu’inattendu, peut être bénéfique dans certaines situations.
L’utilisation de dermocorticoïdes est utile pour modérer cet hyperbourgeonnement et accélérer l’épidermisation des plaies, en particulier quand l’hyperbourgeonnement est au contact des bords de la plaie. Cependant, il convient de rester vigilant face au risque d’atrophie cicatricielle qui peut accompagner ce traitement.
Cette approche s’avère particulièrement utile pour traiter des plaies rebelles, telles que les ulcères fibro-scléreux, ou des ulcères artériels post-revascularisation, qui présentent une lenteur de cicatrisation, ainsi que pour les plaies profondes, cavitaires ou de grande surface, qui pourraient autrement nécessiter une greffe.
En pratique, une fois l’hyperbourgeonnement atteint grâce aux pansements inducteurs, ceux-ci sont maintenus jusqu’à obtenir un niveau d’hyperbourgeonnement jugé satisfaisant. Par la suite, l’application quotidienne de dermocorticoïdes en crème épaisse est recommandée pour accélérer l’épidermisation et aplanir les bourgeons. Ce traitement doit impérativement être réalisé sous étroite surveillance médicale en raison du risque infectieux lié à l’usage des dermocorticoïdes et nécessite une expertise spécifique.
Dans certains cas, si la plaie présente une croissance inégale des bourgeons, l’application de dermocorticoïdes peut être adaptée, par exemple en alternant un jour sur deux ou deux fois par semaine, afin de cibler de manière optimale les zones nécessitant un traitement.

Ulcère : ne pas passer à côté de l’insuffisance veineuse fonctionnelle
L’ulcère veineux fonctionnel peut se cacher derrière une imagerie normale, mais ses conséquences sont bien réelles. Découvrez comment éviter ce piège fréquent en posant les bonnes questions et en réalisant un diagnostic clinique minutieux
se définit comme une absence de lésions veineuses profondes ou superficielles.
Les examens d’imagerie comme l’échographie doppler veineux des MI ne retrouvent pas d’anomalies.
Tout comme l’insuffisance veineuse classique, l’insuffisance veineuse fonctionnelle entraîne une hyperpression veineuse dans les membres inférieurs avec des conséquences similaires (douleurs, ulcères et œdèmes).
Peut aussi aggraver une insuffisance veineuse ou veino-lymphatique lésionnelle préexistante.
Quelles en sont les causes ?
Les principales causes d’hyperpression veineuse incluent :
- l’obésité
- la chirurgie de hanche de genou et de cheville
- les troubles de la marche
- la sédentarité
- l’ankylose de cheville, la déformation de cheville permanente
- l’orthostatisme prolongé
L’obésité provoque une hyperpression veineuse dans les membres inférieurs.
De même, une personne debout, assise trop longtemps ou piétinant toute la journée développera aussi une hyperpression veineuse.
La chirurgie de la hanche, du genou ou de la cheville peut causer des perturbations importantes du retour veineux.
De même que l’ankylose ou les déformations permanentes de la cheville (ex. : pied en varus équin irréductible).
Les troubles de la marche, comme un déficit de pression au niveau du mollet ou un mauvais appui plantaire, entraînent une mauvaise chasse veineuse.
De même, un patient sédentaire marchant moins de 30 minutes par jour peut développer une insuffisance veineuse ou veino-lymphatique fonctionnelle avec des œdèmes.
Bilan
Pour identifier une insuffisance veineuse fonctionnelle, il est essentiel de poser les bonnes questions lors de l’interrogatoire et de réaliser un examen clinique minutieux.
Parfois, l’insuffisance veineuse fonctionnelle est difficile à détecter, car l’œdème peut être absent lors de la consultation.
Dans ce cas, demander au patient s’il ressent des jambes lourdes, des douleurs en fin de journée, ou s’il observe un gonflement des chevilles ou des œdèmes en fin de journée, des signes qui orientent vers une insuffisance circulatoire.
Les ulcères veineux fonctionnels, comment les reconnaître ? 🩺
Les ulcères liés à l’insuffisance veineuse fonctionnelle ressemblent beaucoup aux ulcères veineux classiques. Leur apparence et leur localisation sont similaires. Ils peuvent être accompagnés de signes cutanés classiques compliquant l’insuffisance veineuse comme l’atrophie blanche ou la dermite ocre.
Le piège ? Pas de lésions visibles à l’échographie.
Comment traiter ces ulcères ? 🛠️
Le traitement est identique à celui des ulcères veineux classiques :
Contention et compression adaptées
Mesures d’hygiène (Repos avec jambes surélevées, Arrêt du piétinement ou des stations debout prolongées 🚶, etc…)
Lavage, détersion et pansements appropriés
Le piège à éviter ⚠️
Imaginez : une personne âgée, vivant seule, avec un petit ulcère douloureux au niveau de la cheville, mais sans œdème visible. On lui prescrit simplement un pansement, mais pas de contention. Pourtant, en posant les bonnes questions, on aurait su qu’elle reste assise toute la journée dans son fauteuil, avec des chevilles qui gonflent en fin de journée… Une contention aurait résolu le problème.
Conclusion
Posons les bonnes questions pour identifier l’insuffisance veineuse fonctionnelle.
Un ulcère lié à l’insuffisance veineuse fonctionnelle nécessite toujours une contention adaptée.
Si un ulcère des membres inférieurs à fond fibrineux n’a pas d’explication inflammatoire (comme une infection, artériopathie, hyperappui, prise de médicaments, allergie, etc.) et qu’aucune lésion veineuse n’est visible à l’imagerie, il faut suspecter une hyperpression veineuse fonctionnelle.

Le Pouvoir des Soins Simples : une Leçon de Guérison
Imaginez une patiente de 87 ans, entrant dans une institution médicalisée. Dès son arrivée, elle présente un ulcère circonférentiel à la jambe droite, accompagné d’un léger œdème. C’est une conséquence de son insuffisance veino-lymphatique. Ne marchant plus, elle reste assise dans son fauteuil roulant, mais parvient encore à faire des transferts. Avec quelques troubles cognitifs, elle suit une corticothérapie à long terme pour une polyarthrite rhumatoïde déformante. Le bilan vasculaire est rassurant : ni AOMI, ni insuffisance veineuse superficielle ou profonde. Mais elle est dénutrie. 🍽️
On décide de mettre en place une contention par kit multitype, avec une protection cutanée, car sa peau est très fine et fragile. 🩹 Malgré ces précautions, les infirmières découvrent une exposition du tendon tibial antérieur sur 3 cm. Le tendon est bien visible. 👀
Ce type de cas n’est malheureusement pas rare. Prendre en charge une telle plaie est un véritable défi. Le tendon, mal vascularisé, est difficile à couvrir. Il peut facilement s’infecter ou nécroser s’il s’assèche. On envisage souvent des traitements de seconde ligne comme la thérapie par pression négative, l’électrostimulation, le PRP, les matrices dermiques, voire une chirurgie de recouvrement. L’immobilisation est également souvent nécessaire. 🚑
À l’examen, une surprise : le tendon est sain. Il n’est ni sec, ni jaunâtre. La bordure et la périphérie ulcérée ne montrent aucun signe d’infection. Lors de la détersion tangentielle au ciseau, un micro-saignement apparaît rapidement. 💉
Compte tenu de la mobilité réduite de la patiente, nous faisons un choix : ne pas l’immobiliser davantage. Nous décidons de maintenir la contention actuelle, sans trop serrer. Un tulle gras en double couche est appliqué sur la zone du tendon, le tout recouvert avec un pansement hydrofibre pour l’ulcère périphérique. Les infirmières, avec une régularité exemplaire, procèdent à une détersion tangentielle du tendon jusqu’à obtenir un micro-saignement. 🏥
Un mois passe. Le tendon, autrefois exposé, est maintenant complètement recouvert d’un tissu de granulation. 🎉
La morale de cette histoire ? Parfois, il suffit de prendre le temps de réfléchir pour simplifier des plaies complexes. Pas besoin de techniques lourdes ou d’hospitalisation. Juste une approche réfléchie et soignée. 🌿
Comment traiter efficacement certaines plaies d’orteils du pied diabétique sans recourir à l’amputation
Introduction
Certaines plaies du pied diabétique, notamment celles situées sur la face dorsale des orteils avec exposition osseuse ou articulaire, posent un vrai défi de cicatrisation.
Trop souvent, ces plaies de petite taille (moins d’un centimètre) mènent à une amputation, alors qu’il existe une approche simple, mécanique et efficace, à mettre en œuvre avant tout traitement complexe.
Vérifications indispensables avant tout traitement local
Avant d’appliquer une stratégie de traitement local, il est impératif de vérifier :
- L’absence d’infection ostéo-articulaire
- L’absence d’artériopathie des membres inférieurs
Pourquoi ces plaies sont si problématiques ?
La zone exposée empêche la fermeture spontanée. Les mouvements de l’orteil aggravent l’exposition. La proximité de l’os augmente les risques d’infection, rendant la cicatrisation difficile.
Une méthode simple et mécanique pour favoriser la cicatrisation
1. Immobilisation de l’orteil
L’orteil malade est immobilisé avec l’orteil adjacent qui sert de tuteur, à l’aide de sparadrap.
2. Prévention des frottements
Intercalez une compresse ou un pansement à base d’alginate pour éviter une nouvelle plaie entre les deux orteils.
3. Mise en hyperextension
Placez l’orteil malade en hyperextension avant de le fixer. Cela réduit la surface exposée et rapproche les bords de la plaie.
4. Padding plantaire
Ajoutez une bande Nylex sous les orteils : lors de la marche, les orteils remontent automatiquement en hyperextension.
Résultat : une cicatrisation facilitée
Lorsque les bords de la plaie sont mécaniquement rapprochés (écart < 2 mm), la fermeture devient possible, même avec un os exposé.
Quel pansement utiliser ?
Utilisez un pansement favorisant un milieu humide contrôlé :
- Pansements hydrocellulaires
- Pansements à base de NOSF
Objectif : éviter les bordures sèches ou macérées.
Conclusion
Avec cette approche locale et mécanique, plusieurs cas ont été cicatrisés sans recourir à des traitements secondaires coûteux ou à l’amputation.
Avant toute solution invasive, testez cette méthode simple, reproductible.

Pansements humidifiés : la confusion persiste
Il y a quelques mois, j’avais publié un post sur l’humidification systématique des alginates de calcium. La plupart des experts avaient indiqué que cette pratique n’était nécessaire que dans certaines circonstances.
Pourtant, ce discours continue d’être relayé par certains représentants commerciaux. Cela génère de la confusion, notamment avec les hydrofibres, dont l’apparence et la texture sont parfois similaires aux alginates.
Résultat ? Certains pensent à tort qu’il faut humidifier entièrement les hydrofibres avant application, comme pour les alginates de calcium. Cela peut entraîner des risques importants de macération.
📋 Un exemple récent : J’ai vu la semaine dernière un patient de 59 ans souffrant de mycoses interdigitales importantes après avoir porté des bottes pendant une longue période. Des hydrofibres humidifiés avaient été appliqués, provoquant une dermite étendue sur l’avant-pied avec une colonisation bactérienne importante.
À première vue, on aurait pu croire à une neuropathie diabétique périphérique tant la plaie était grave. Heureusement, ce n’était pas le cas, car cela aurait pu mener à une amputation transméta-tarsienne.
Cet exemple illustre les conséquences graves qu’un discours commercial répété peut avoir en semant la confusion dans l’esprit des professionnels de santé.
⚠️Il est crucial de rester vigilant face aux informations relayées et de s’assurer que nos pratiques sont adaptées à chaque type de pansement.
Quand la plaie raconte une autre histoire
Dans ce dernier volet sur l’hyperbourgeonnement, je souhaite partager un cas particulièrement instructif concernant une patiente de 81 ans.
👵 Le Contexte :
La patiente, souffrant de dermatoporose, consulte pour un ulcère au mollet gauche, apparu après une déchirure cutanée et évoluant dans un contexte d’insuffisance veino-lymphatique.
🔍 Examen et Traitement :
Initialement, l’ulcère présentait un hyperbourgeonnement. Un traitement comprenant des dermocorticoïdes sous pansement hydrocellulaire siliconé, associé à des mesures de contention et d’hygiène (repos avec jambes surélevées), a été mis en place.
🔄 Suivi :
Quinze jours après le début du traitement, la patiente revient pour un suivi. L’œdème est bien maîtrisé et l’hyperbourgeonnement a disparu. Cependant, contrairement à ce qu’on espère habituellement, l’ulcère n’a pas réduit de taille. Bien que la surface de la plaie semble plane, la taille de l’ulcère reste inchangée. De plus, un liseré inflammatoire est toujours présent autour de la plaie, sans processus d’épidermisation, et la zone périphérique ainsi que le fond de l’ulcère restent inflammatoires.
🔬 Découverte :
Des biopsies réalisées au punch, révèlent un carcinome basocellulaire. La patiente est alors prise en charge par un chirurgien plasticien pour une exérèse complète de la lésion. La cicatrisation se poursuit sans greffe, aidée par un pansement spécialisé et une contention continue.
La patiente est prise en charge par un chirurgien plasticien qui réalise une exérèse complète de la lésion, sans recourir à une greffe. La plaie creusante est laissée en cicatrisation dirigée. Un pansement composé d’alginate de calcium est appliqué pour favoriser ce processus, recouvert d’un pansement hydrocellulaire à bordure siliconée, avec la poursuite de la contention multicouche.
📅 Résultat et Surveillance :
La cicatrisation de la plaie est complète après quelques semaines. Étant donné les antécédents significatifs d’exposition solaire de la patiente, une surveillance dermatologique annuelle de tout le corps est établie pour prévenir d’éventuelles complications futures
Conclusion : face à un hyperbourgeonnement qui ne répond pas aux traitements habituels ou qui présente une localisation atypique il faut systématiquement suspecter un cancer.
Résumé des Enseignements :
Un hyperbourgeonnement peut être un signe de granulome inflammatoire hyperplasique, souvent dû à une réaction à corps étranger ou une infection.
Il peut aussi masquer un cancer, nécessitant une vigilance accrue.
Identifier les complications des sites donneurs de greffe pour mieux traiter
Lorsqu’une greffe cutanée est réalisée, l’attention est souvent portée sur la zone receveuse. Pourtant, la gestion du site donneur est tout aussi cruciale pour éviter des complications pouvant compromettre la récupération du patient.
Complications immédiates
Certaines complications surviennent rapidement après le prélèvement et nécessitent une prise en charge adaptée :
- Saignement : maîtrisé avec des pansements hémostatiques comme les alginates de calcium imprégnés de sérum adrénaliné ou de sulfate ferrique.
- Douleur : souvent intense dans les premiers jours, elle peut être soulagée par l’utilisation de pansements adaptés comme les alginates et les hydrocellulaires.
- Surinfection : peu fréquente (environ 3 % des cas), elle peut être bactérienne (traitée par des antibactériens locaux) ou candidosique (présence de pustules nécessitant un antifongique local).
- Hyperbourgeonnement : fréquent et nécessitant l’application de dermocorticoïdes de classe 2.
- Retard de cicatrisation : un site donneur bien pris en charge cicatrise en général en trois semaines.
- Eczéma de contact : causé par certains pansements ou antiseptiques.
- Prurit sine materia : démangeaisons sans lésions visibles, pouvant être soulagées par des émollients ou des antihistaminiques oraux.
- Nécrose : rare, elle peut être liée à une infection, un phénomène vasomoteur, ou à la prise de certains médicaments ou toxiques (tabac, cannabis, etc.).
Complications retardées
D’autres complications apparaissent à distance de la greffe et peuvent affecter la qualité de vie du patient :
- Cicatrices pathologiques : hypertrophiques, chéloïdes ou rétractiles, elles nécessitent une prévention, notamment chez les sujets jeunes, avec une pressothérapie adaptée.
- Cicatrices dyschromiques : modification de la pigmentation de la peau au niveau du site donneur.
- Cicatrices instables : elles apparaissent en cas de prélèvements répétés ou étendus avec des réouvertures fréquentes.
- Alopécie : en cas de prélèvement trop profond sur le cuir chevelu.
- Cancers cutanés secondaires (très rares) : carcinome basocellulaire et kératoacanthome.
- Dermatoses tardives : plaques érythémateuses, bulles, érosions et croûtes pouvant survenir des mois ou des années après la greffe (exemples : pustulose érosive, pemphigoïde bulleuse localisée).
- Lésions sur la zone greffée : si des lésions similaires apparaissent sur la zone receveuse, une biopsie est recommandée pour rechercher un pyoderma gangrenosum superficiel ou une pustulose érosive des membres inférieurs.
Conclusion
La gestion optimale des sites donneurs de greffe est essentielle pour assurer une bonne cicatrisation et éviter les complications. Chaque technique de prélèvement présente ses propres risques, et une surveillance rigoureuse est indispensable pour garantir le meilleur résultat possible.
Quel pansement mettre sur un ongle incarné ?
Peut-on mettre un hydrocolloïde sur un ongle incarné ?
Découvrez les pansements adaptés pour soigner un ongle incarné, les erreurs à éviter et des conseils pour une cicatrisation optimale après une chirurgie.
L’autre jour, une podologue m’a posé cette question intrigante. On parle souvent de protocoles variés entre les podologues, les infirmiers, les médecins et les chirurgiens : hydrocellulaires, tulles et interfaces, alginates de calcium, hydrofibres, etc. Pourtant, les résultats restent souvent très aléatoires.
Je me suis alors demandé : Quel(s) pansement(s) utiliser pour un ongle incarné, que ce soit pour des soins locaux ou après une chirurgie ? Et surtout, quels pansements doit-on éviter ? 🤔
Les ongles incarnés résultent souvent d’une prédisposition génétique couplée à une pression externe excessive. Cela crée un conflit douloureux entre les bords de l’ongle et les tissus environnants. Ces situations peuvent s’aggraver avec la transpiration et la macération, allant d’une simple rougeur à la formation d’un granulome inflammatoire purulent, accompagné de douleurs et d’un bourrelet recouvrant l’ongle.
Il apparaît clairement qu’il ne faut pas utiliser de pansements favorisant un milieu humide. Cela risque d’aggraver la situation, avec un risque d’infection et de croissance d’un granulome ou d’un bourrelet. En post-opératoire, on constate parfois l’apparition d’un nouveau granulome, dû au choix du pansement. Un milieu humide est à proscrire ! 🚫
Contrairement aux plaies chroniques où la cicatrisation en milieu humide est recommandée, pour l’ongle incarné, il faut maintenir un milieu aussi sec que possible.
Les pansements les plus adaptés sont les alginates de calcium purs. Évitez les hydrofibres, qui se gélifient et entraînent une humidité persistante, ainsi que les hydrocolloïdes, hydrocellulaires, interfaces et tulles. Les compresses non tissées contenant de la viscose et du polyester ne sont pas non plus indiquées.
À la maison, si la plaie suinte peu, laissez l’orteil à l’air libre et portez des tongs ou des claquettes. Pour sortir, un alginate de calcium maintenu avec du sparadrap ou une bande auto-adhésive aérée suffit. Évitez surtout les compresses non tissées.
En post-opératoire, même approche : utilisez des alginates de calcium purs jusqu’à ce qu’il n’y ait presque plus d’exsudats, puis laissez l’orteil à l’air. Les croûtes qui se forment ralentissent la cicatrisation et préviennent la formation de granulomes ou de bourrelets.
Hyperbourgeonnement des plaies : identifiez les pansements responsables !
Qu’est-ce que l’hyperbourgeonnement induit ?
L’hyperbourgeonnement est un phénomène qui ralentit ou bloque la cicatrisation d’une plaie. Certains pansements couramment utilisés peuvent être à l’origine de ce problème, en particulier ceux contenant de la Carboxyméthylcellulose (CMC).
Quels pansements favorisent l’hyperbourgeonnement ?
1. Hydrocolloïdes
La totalité des pansements hydrocolloïdes contiennent de la CMC et favorisent donc potentiellement l’hyperbourgeonnement.
2. Hydrogels
Presque tous les hydrogels utilisés actuellement contiennent aussi de la CMC.
3. Alginates de calcium
Certains alginates peuvent contenir de la CMC. Soyez attentif aux compositions telles que :
- Askina Sorb
- Biatain Alginate
- Melgisorb
- Algoplaque
4. Hydrofibres à base de CMC
- Hydrofibres contenant de la CMC pure : Aquacel, Kerracel.
- Hydrofibres contenant la CMC associée à d’autres composants : Biatain Fiber, Biosorb.
5. Interfaces imprégnées
Certaines interfaces seules ou associées à d’autres matériaux contiennent également de la CMC, comme la gamme URGO, Lomatuell H, Physiotull.
6. Autres pansements inducteurs
- Tulles gras
- Hydrofibres contenant du Polyalcool de Vinyle (PVA), comme Exufiber
Que faire en cas d’hyperbourgeonnement ?
Étape 1 : Arrêter immédiatement le pansement responsable
Il est primordial d’identifier et d’arrêter l’utilisation du pansement incriminé.
Étape 2 : Appliquer un dermocorticoïde
Sous prescription médicale, appliquer un dermocorticoïde de classe 2, en couche épaisse, directement sur les bourgeons. Exemples :
- Locoïd
- Nérisone
- Diprosone
- Betneval
- Flixovate
- Efficort
Ce traitement doit être maintenu jusqu’à l’aplanissement complet des bourgeons, généralement sous un pansement hydrocellulaire.
Étape 3 : Reprendre une cicatrisation saine
Après résolution du problème, choisissez un pansement non inducteur d’hyperbourgeonnement pour poursuivre la cicatrisation (par exemple, un hydrocellulaire ou une autre classe de pansements).
Conclusion
Le choix adéquat du pansement est crucial pour une cicatrisation saine et rapide. Connaître les composants à risque permet d’éviter efficacement l’hyperbourgeonnement et ses conséquences négatives.

Rhéophérèse en cicatrisation : une technique innovante pour les plaies difficiles à cicatriser
Qu’est-ce que la rhéophérèse ?
La rhéophérèse est une technique particulière de filtration du sang, réalisée en deux étapes : d’abord une aphérèse qui sépare le plasma des cellules sanguines, puis une filtration du plasma à travers un « rheofilter ». Ce filtre retient spécifiquement les macromolécules responsables de l’hyperviscosité du sang (fibrinogène, IgM, LDL-cholestérol, facteur de Willebrand, alpha-2-macroglobuline). En abaissant la viscosité sanguine, la rhéophérèse vise à améliorer la perfusion microvasculaire et à réduire l’inflammation.Rhéophérèse et plasmaphérèse : quelles différences ?
La rhéophérèse est une forme spécifique de plasmaphérèse. Contrairement à la plasmaphérèse classique, la filtration est ici double et sélective, avec peu de nécessité de remplacer le plasma (parfois un apport d’albumine est réalisé). Le risque d’allergie est faible par rapport à la plasmaphérèse, mais le coût par séance est plus élevé, en raison du filtre dédié.Quels sont les résultats cliniques observés ?
La rhéophérèse améliore la microcirculation, accélère la cicatrisation, réduit la douleur, et peut être couplée à la dialyse chez certains patients.Indications de la rhéophérèse en cicatrisation
- Ulcère sur AOMI (artériopathie oblitérante des membres inférieurs)
- Pied diabétique ischémique non-revascularisable
- Calciphylaxie urémique ou non urémique
- Ulcération digitale de la sclérodermie systémique
- Indication expérimentale : angiodermite nécrotique
Premiers résultats publiés
- Ulcère ischémique du membre inférieur : des études prospectives montrent une amélioration de l’oxygénation tissulaire et une réduction de la surface de plus de 50 % à 3 mois chez environ la moitié des patients non revascularisables.
- Pied diabétique ischémique : les études pilotes indiquent une accélération de la cicatrisation de 30 % et une limitation des amputations majeures.
- Calciphylaxie : la rhéophérèse est reconnue comme traitement adjuvant de 2e intention, souvent couplée à la dialyse chez les patients insuffisants rénaux.
- Ulcération digitale de la sclérodermie : les séances bihebdomadaires permettent une diminution de la douleur et une cicatrisation partielle à complète dans 60 % des cas en 8 semaines.
Protocole de la rhéophérèse en cicatrisation
Les séances sont réalisées en centre de dialyse sous la supervision d’un néphrologue. Chaque séance dure en moyenne 2 heures, à raison de deux fois par semaine, avec une réévaluation à J30 puis J60. Le protocole type : deux séances par semaine pendant 3 semaines, puis une séance hebdomadaire jusqu’à amélioration.Limites et complications potentielles
Limites du traitement
- Peu d’études randomisées, effectifs limités
- Absence de recommandation formelle en cicatrisation
- Matériel dédié et filtre à usage unique onéreux
- Protocole long, initialement intensif
- Nécessité d’un cathéter veineux central chez les patients non dialysés (risques infectieux/thrombotiques)
Complications potentielles
- Hypotension, crampes, céphalées, hypocalcémie
- Infections, thromboses, hématomes, pneumothorax liés au cathéter
- Hypofibrinémie excessive, thrombopénie transitoire, risque hémorragique
- Rares réactions allergiques à la membrane, risque d’embolie gazeuse
Perspectives futures pour la rhéophérèse en cicatrisation
- Lancement d’essais randomisés contrôlés
- Développement de filtres de nouvelle génération limitant la perte d’albumine
- Utilisation de biomarqueurs pour prédire la réponse (fibrinogène, e-sélectine, viscosité plasmatique)
- Thérapies combinées : rhéophérèse + thérapie cellulaire (PRP, matrice dermique, derme artificiel) ou réhabilitation vasculaire

Conclusion : la rhéophérèse en cicatrisation, une innovation à surveiller
La rhéophérèse en cicatrisation ouvre de nouvelles perspectives dans la prise en charge des plaies complexes et difficiles à guérir. Elle reste une stratégie de 2e intention, en particulier pour les plaies ischémiques en échec de revascularisation et de soins locaux. Pour les indications établies, le rapport bénéfices/risques est jugé favorable. L’angiodermite nécrotique, quant à elle, nécessite encore une évaluation expérimentale et un encadrement multidisciplinaire.
Algorithme décisionnel en quatre étapes
- Optimisation des traitements de première intention
- En cas d’échec, évaluation de la perfusion, de la viscosité et des comorbidités
- Décision collégiale de rhéophérèse en cicatrisation en cas d’impasse thérapeutique
- Réévaluation à 1 et 2 mois : arrêt si absence de réponse
FAQ – Rhéophérèse en cicatrisation
Qu’est-ce que la rhéophérèse ?
La rhéophérèse est une technique d’aphérèse spécialisée, destinée à éliminer du plasma sanguin certaines macromolécules responsables d’une viscosité excessive. Elle vise à améliorer la microcirculation et la cicatrisation des plaies difficiles, notamment dans les contextes d’ischémie ou de pathologies vasculaires.
Quelle est la différence entre rhéophérèse et plasmaphérèse ?
La rhéophérèse se distingue de la plasmaphérèse par une double filtration sélective du plasma, permettant de cibler spécifiquement les molécules responsables de l’hyperviscosité, avec moins de nécessité de remplacement du plasma. Le risque d’allergie est également plus faible.
Dans quels cas la rhéophérèse est-elle indiquée en cicatrisation ?
Elle est utilisée en cas d’ulcère sur AOMI, pied diabétique ischémique non-revascularisable, calciphylaxie urémique ou non urémique, ulcérations digitales de la sclérodermie systémique, et en expérimental pour l’angiodermite nécrotique.
La rhéophérèse peut-elle être réalisée en même temps qu’une dialyse ?
Oui, la rhéophérèse peut être couplée à une séance de dialyse chez les patients insuffisants rénaux, en particulier dans la prise en charge de la calciphylaxie.
Quels sont les principaux risques ou complications de la rhéophérèse ?
Les principaux risques incluent hypotension, crampes, hypocalcémie, complications liées au cathéter (infection, thrombose), hypofibrinémie, thrombopénie transitoire, et plus rarement réactions allergiques à la membrane ou embolie gazeuse.
Dermite de contact : protocole complet de traitement et prévention des récidives
Comprendre la dermite de contact : irritative ou allergique
Les dermites de contact, qu’elles soient irritatives ou allergiques, peuvent compromettre la cicatrisation des plaies. Leur prise en charge repose sur un protocole clair, applicable aux deux formes.
Traitement local : les étapes essentielles
Éviction complète de l’agent causal
L’identification et l’élimination de l’agent irritant ou allergène est la priorité absolue.
Notez systématiquement cet agent dans le dossier clinique et informez le patient, l’équipe soignante et les correspondants.
Nettoyage doux, sans produit agressif
Évitez antiseptiques, antibiotiques locaux, savons parfumés. Utilisez uniquement un syndet à pH neutre, non irritant.
Lésions exsudatives : assèchement local
Utilisez des pansements absorbants, non occlusifs, non adhésifs et hypoallergéniques : interfaces, fibres superabsorbantes, alginates.
Application précoce de dermocorticoïdes
En l’absence d’infection locale, appliquez un dermocorticoïde de classe 2 dès le départ. Suivez une cure décroissante rapide :
- 2x/jour → 1x/jour → un jour sur deux → 2x/semaine avec un émollient
Puis relais par un émollient quotidien à l’arrêt des corticoïdes.
Traitements complémentaires
Ajoutez un antihistaminique oral si besoin (prurit, urticaire).
Réservez une corticothérapie orale aux formes généralisées, rares et sévères.
Prévention des récidives : stratégie rigoureuse
Traçabilité de l’agent causal
Inscrivez clairement l’agent déclencheur dans le dossier.
Informez tous les intervenants. Ajoutez une alerte dans le suivi si nécessaire.
Supprimez les produits irritants
Évitez :
- Antiseptiques (chlorhexidine, bétadine, etc…)
- Antibiotiques locaux
- Lingettes imprégnées agressives
- Savons parfumés ou détergents
Choisissez les bons pansements
Évitez :
- Pansements occlusifs (hydrocolloïdes, polyuréthanes, siliconés)
- Adhésifs agressifs
Préférez :
- Pansements non adhésifs
- Interfaces
- Fibres superabsorbantes
- Alginates
Surveillance à long terme
Même après cicatrisation, le risque de rechute persiste si l’agent causal est réintroduit.
Maintenez les précautions dans le temps. Formez le patient et les aidants.
Conclusion : traitement + prévention = cicatrisation durable
Une dermite bien soignée, c’est :
- Une éviction rigoureuse
- Un traitement local maîtrisé
- Une vigilance durable

Tulle gras : indications, propriétés et bon usage en plaies
Introduction
Premier pansement moderne, le tulle gras (paraffin/petrolatum gauze) est un pansement non adhérent et non absorbant encore fréquemment utilisé.
Utilisé à tous les stades de la cicatrisation, pour les plaies aiguës et chroniques, brûlures superficielles/partielles limitées, greffes cutanées (donneur/receveur) et certaines plaies post-opératoires peu exsudatives, il doit toujours être associé à un pansement secondaire absorbant adapté à l’exsudat.
Les tulles « non médicamenteux » (vaseline/paraffine, triglycérides neutres) se distinguent des tulles « médicamenteux » (povidone-iode, chlorhexidine, argent) à utiliser de façon ciblée et limitée dans le temps en cas de charge bactérienne critique. Les recommandations récentes rappellent que le choix du pansement doit être individualisé selon le profil lésionnel, l’exsudat et la douleur, sans supériorité démontrée d’une famille unique de pansements.
Définition et composition du tulle gras
Le tulle gras est une gaze à mailles larges imprégnée d’une substance lipophile (vaseline/paraffine « soft »). Certaines références modernes utilisent des triglycérides neutres (ex. Atrauman®), et des variantes « médicamenteuses » intègrent povidone-iode (ex. Inadine®), chlorhexidine (ex. Bactigras®) ou argent (ex. Atrauman® Ag). Ces interfaces laissent passer l’exsudat vers un pansement secondaire absorbant.
Toujours en fibres naturelles : généralement des fibres de coton imprégnées de paraffine. Usage historique depuis la Grande Guerre.
il ne doit pas être confondu avec les interfaces constituées de fibres de synthèse comme par exemple le silicone (ex. Mepitel®) ou de fibres de CMC/hydrofibre qui ne sont pas des « tulles ».
Historique : invention et diffusion clinique
Le tulle gras est mis au point en 1915 par Auguste Lumière (HCL Lyon) : gaze à mailles ~2 mm imprégnée de vaseline et baume du Pérou, stérilisée à l’autoclave. Diffusé en 1917-1918, la composition a évolué (le baume du Pérou étant un allergène fréquent), mais l’interface grasse s’est diffusée en brûlologie et chirurgie dès la Première Guerre mondiale.
Propriétés et mécanismes d’action
- pansement non adhérent
- Maintien d’un milieu humide : favorise migration kératinocytaire et ré-épithélialisation ; évite la dessiccation.
- Aucune absorption propre : l’équilibre humidité/macération dépend du pansement secondaire (compresses, hydrofibre/alginate, foam).
- Tissu à maillage large (risque d’accrochage si granulation très proéminente).
- Non absorbants, très peu adhérents, découpables.
- Peuvent favoriser un hyper-bourgeonnement en cas d’excès d’humidité/occlusion (surveiller et corriger via secondaire/compression).
Indications et contre-indications
Indications usuelles (tulle non médicamenteux)
- Plaies aiguës peu à modérément exsudatives : dermabrasions, plaies suturées/greffées (donneur/receveur), brûlures superficielles ou du 2e degré limitées.
- application sous compression dans l’ulcère veineux (atraumatisme), la compression restant le traitement étiologique de référence.
Indications spécifiques (tulles médicamenteux)
- Plaies avec charge bactérienne critique/risque infectieux : povidone-iode (Inadine®) courte durée ; alternative : chlorhexidine (Bactigras®) selon tolérance.
À éviter / précautions
- Escarres : éviter la gaze simple ; privilégier d’autres classes de pansements selon l’exsudat.
- Plaies très exsudatives : risque de macération si secondaire inadapté.
- Allergies : antécédents au baume du Pérou, lanoline, chlorhexidine ou iode.
Compléments (indications pratiques)
- Utilisables à tous les stades de la cicatrisation avec adaptation (choix du secondaire/rythme de change).
- Plaies très exsudatives : association à un absorbant/super-absorbant/hydrofibre/alginate).
- Plaies peu exsudatives et fin de cicatrisation.
- Large gamme de plaies : traumatiques, post-op, ulcères sous compression, sites de greffes.
- Utiles pour maintenir des greffes en place et protéger les lits fragiles.
- Peuvent servir d’interface quand un pansement primaire est mal toléré (ex. alginates, super-absorbants, ou sous TPN pour réduire l’adhérence/douleur)
Contre-indications
- Intolérance/Allergie à l’un des composants (paraffine, baume du Pérou, lanoline, CHX, iode).
- Pas d’utilisation conjointe avec les pansements au DACC (SORBACT®) car « le gras » inhibe les capacités bactériostatiques du DACC.
- Hyper-bourgeonnement non contrôlé malgré ajustement humidité/occlusion.
Efficacité clinique et limites
Les synthèses méthodologiques soulignent des preuves faibles et hétérogènes pour comparer les familles de pansements en plaies chroniques. Dans les brûlures superficielles/partielles, certaines alternatives (interfaces siliconées, argent, hydrogels/biomatériaux) montrent par endroits des bénéfices (douleur, vitesse) mais la qualité d’ensemble reste basse. Un ECR (adultes, brûlures superficielles-partielles) a montré que la vaseline topique pouvait être au moins aussi efficace que la sulfadiazine argentique (temps de ré-épithélialisation, infection). Dans les ulcères veineux, aucun pansement n’a démontré une supériorité robuste hors stratégies spécifiques ; la compression est déterminante.
Limites : absence d’absorption ; risque de macération si exsudat élevé ; possibles intolérances/allergies (baume du Pérou, lanoline) ou aux antiseptiques (CHX, PVP-I).
Conseils d’utilisation
- Évaluer (type, profondeur, exsudat, douleur) et sélectionner la taille (ex. 5×5, 10×10, 20×20).
- Nettoyer au NaCl 0,9 % ; sécher délicatement la peau périlésionnelle.
- Poser 1 seule feuille de tulle sur la plaie, sans tension ni plis.
- Ajouter un pansement secondaire absorbant (compresses stériles, hydrofibre/alginate/hydrocellulaire/superabsorbant), pas une autre compresse grasse.
- Maintenir par bande/adhésif non occlusif.
- Changer toutes les 24–48 h (jusqu’à 72–96 h si exsudat faible et/ou antiseptique avec durée validée). Si adhérence : irriguer au NaCl 0,9 % et retirer doucement (ne pas arracher à sec).
Points de vigilance : éviter les surépaisseurs ; surveiller la macération des berges ; limiter la durée des antiseptiques puis revenir à une interface neutre.
Difficultés pratiques
- Mailles larges : des bourgeons peuvent s’y coincer → risque saignement/douleur ; précautions : irrigation, interface silicone alternative, ou mailles plus fines.
- Tendance à sécher/durcir si intervalle de change trop long → humidifier/irriguer avant retrait.
- Intérêt en greffes : un léger durcissement peut agir en adhésif de bolster pour maintenir les greffons (selon protocole chirurgical).
Modalités d’utilisation complémentaires
- Sous compression dans les VLU (traitement étiologique de référence).
- Phase d’hyper-exsudat : préférer hydrofibre/alginate/superabsorbant en primaire ; réserver le tulle à l’épidermisation/faible exsudat.
- Antimicrobiens (PVP-I, CHX, Ag) : usage ciblé, limité, réévalué.
Effets observés sur la plaie
- Diminution des traumatismes et de la douleur au retrait vs. gaze sèche.
- Maintien d’un milieu humide favorisant la ré-épithélialisation.
- Surveillance : macération des berges, bourgeon charnu/folliculite si occlusion excessive, signes d’intolérance/allergie (baume du Pérou, lanoline, CHX, iode).
Alternatives et associations
- Interfaces siliconées (ex. Mepitel®) : non-adhérence supérieure et confort, utile si peau fragile/skin tears/greffes.
- Interfaces lipido-colloïdes (Urgotul®) et matrices TLC-NOSF (UrgoStart®) : interfaces « actives ».
- Hydrofibres/Alginates/pansements superabsorbants : préférables si exsudat élevé.
- Pansements antimicrobiens (Ag, PVP-I, PHMB, DACC) : en cas d’infection locale/charge critique, usage ciblé.
Remboursement et disponibilité
France – LPPR (LPP)
- Les pansements (dont pansements vaselinés/tulles gras) sont inscrits à la LPP.
- NOUVEAUTÉ 1er avril 2025 : première délivrance en officine des pansements inscrits LPP limitée à 7 jours (arrêté du 13/03/2025, JO 19/03/2025). Renouvellement possible selon durée de traitement mentionnée.
- Traçabilité : conserver preuves d’évaluation clinique et indication sur l’ordonnance.
Suisse – LiMA/MiGeL (AOS)
La LiMA/MiGeL liste les dispositifs pris en charge par l’AOS. La prise en charge des interfaces de contact dépend de leur inscription et des montants maximaux LiMA. Vérifier la référence et la position LiMA locales.
Belgique – INAMI
- Plaies chroniques : intervention pour pansements actifs sur autorisation du médecin-conseil.
- En officine : intervention directe d’environ 20 % pour certains pansements actifs listés (conditions réglementaires).
Disponibilité (sélection par pays)
France
- Cuticell Classic – BSN Medical : 5×5 cm, 10×10 cm
- Phartulle – Evolupharm : tailles standards
- TulleGras M.S. – Mylan (Viatris) : 5×10 cm, 10×10 cm, 10×40 cm, 20×20 cm
- Lomatuell H – Lohmann-Rauscher : 5×5 cm, 10×10 cm, 10×20 cm, 10×30 cm
- Jelonet – Smith & Nephew : 5×5 cm, 10×10 cm, 10×40 cm, rouleau 15 cm×2 m
- Sylatulle – Sylamed : 5×5 cm
- Biogaran Pansement Tulle Vaseliné – Biogaran : 5×5 cm
Suisse
Disponibilité des marques internationales : Cuticell, Lomatuell H, Jelonet, Adaptic, Grassolind. Tailles similaires à la France.
Belgique
- Lomatuell H – Lohmann-Rauscher : 5×5 cm, 10×10 cm, 10×20 cm
- Jelonet – Smith & Nephew : 10×40 cm
- Méditulle – Euromedis : tailles standards
Conclusion
Pionnier des pansements modernes, le tulle gras reste une bonne interface atraumatique pour plaies peu à modérément exsudatives et certaines brûlures superficielles, à condition d’être couplé à un pansement secondaire absorbant et intégré dans une stratégie étiologique (ex. compression pour ulcère veineux). Les preuves comparatives demeurent limitées ; le choix doit être individualisé (exsudat, site, douleur, allergènes, objectifs). En cas d’exsudat élevé, de mauvaise tolérance, de peau très fragile ou d’objectif d’accélération de la cicatrisation, envisager plutôt des alternatives (interfaces siliconées, TLC/TLC-NOSF, hydrocellulaires/hydrofibres/alginates).
Gagnez en efficacité dans vos soins des plaies avec le Cicannuaire !
Cette base de données spécialisée vous aide à choisir rapidement le bon pansement, la crème adaptée ou le dispositif idéal. Conçu par des experts en cicatrisation, il s’adresse aux infirmiers, médecins, podologues et chirurgiens. Recherche par filtres, plans de soins personnalisés, mises à jour régulières… Un outil essentiel pour les professionnels du soin, des plaies chroniques aux plaies aiguës.
FAQ
Quel est la bonne orthographe du mot tulle gras ?
le mot s’écrit « tulle gras » et non tulgras, tul gras, tulles gras, tullegras, tulle grasse comme on peut le voir parfois.
Quel est l’intérêt du tulle gras dans le traitement des plaies chroniques ou post-opératoires ?
Il protège le lit de plaie, limite l’adhérence au pansement secondaire et maintient un milieu humide. Utile en post-opératoire superficiel, mais limité en plaies chroniques où des pansements modernes sont généralement préférés.
Dans quels cas peut-on utiliser le tulle gras en toute sécurité ?
Plaies superficielles, brûlures du 1er degré, 2e degré superficielles et limitées, greffes cutanées (donneur/receveur), plaies post-opératoires peu exsudatives, avec un secondaire adapté.
Quelles sont les contre-indications ou situations à éviter avec le tulle gras ?
Plaies infectées, très exsudatives, ulcères chroniques évolués, escarres profondes/cavitaires ; allergies aux excipients (baume du Pérou, lanoline) ou aux antiseptiques (CHX, PVP-I) si tulle médicamenteux.
Quelle est la fréquence idéale de changement d’un pansement en tulle gras ?
En règle générale toutes les 24–48 h selon l’exsudat et l’évolution ; plus fréquent si dessèchement/adhérence. Peut être prolongé à 72–96 h si exsudat faible et selon protocole.
Comment appliquer et enlever correctement un tulle gras sans aggraver la plaie ?
Nettoyer au sérum physiologique, sécher la peau périlésionnelle, poser 1 couche de tulle sans tension, recouvrir avec un secondaire absorbant et fixer. Pour le retrait, irriguer au sérum si adhérence ; ne pas arracher à sec.
Le tulle gras aide-t-il réellement à cicatriser et avec quel niveau d’efficacité ?
Il favorise un milieu humide et un retrait atraumatique utile pour les plaies superficielles. Dans les plaies chroniques, l’efficacité est inférieure ou non supérieure aux pansements actifs (hydrocellulaires/hydrocolloïdes).
Le tulle gras a-t-il une action désinfectante ou antibactérienne ?
Non pour les tulles neutres (vaseline/paraffine). Seuls les tulles médicamenteux (ex. povidone-iode, chlorhexidine, argent) ont une activité antimicrobienne et doivent être utilisés de façon ciblée et limitée dans le temps.
Par quoi remplacer le tulle gras quand il n’est pas disponible ?
Compresse vaselinée/compresse de gaze grasse équivalente, interfaces siliconées (ex. Mepitel®), hydrocolloïdes/hydrocellulaires selon l’exsudat ; références proches : Adaptic®, Grassolind®, Medi Tulle®, Lomatuell H®.
Quelle est la différence entre un tulle gras simple et d’autres pansements comme les hydrocolloïdes ?
Le tulle gras est une interface passive non absorbante ; l’hydrocolloïde est un peu absorbant, gère l’exsudat et favorise la cicatrisation humide. Le choix dépend du profil lésionnel et des objectifs (douleur, exsudat, peau fragile).
Le tulle gras est-il pris en charge par la Sécurité sociale ou d’autres dispositifs de remboursement ?
Oui : France (LPPR/LPP), Suisse (LiMA/MiGeL), Belgique (INAMI) avec conditions selon références et tailles. Vérifier les listes et montants en vigueur.
Peut-on utiliser le tulle gras sur une brûlure du 2e degré et jusqu’à quel stade ?
Oui pour les 2e degrés superficiels de surface limitée ; pour les brûlures plus profondes/étendues, privilégier des pansements spécifiques et/ou avis spécialisé.
Que faire si la plaie ne cicatrise pas après plusieurs jours de traitement avec tulle gras ?
Réévaluer l’étiologie (infection, vascularisation, pression), adapter la prise en charge, passer à un pansement actif (hydrocellulaire/hydrofibre/alginate, argent si indiqué) et envisager une orientation spécialisée.
Qu’est-ce qu’un pansement en tulle gras et quelle est sa composition ?
Gaze à mailles larges imprégnée de vaseline ou de paraffine (parfois triglycérides neutres). Existe en versions médicamenteuses (PVP-I, CHX, Ag).
Pourquoi le tulle gras colle-t-il parfois à la plaie ?
Dessèchement de l’imprégnation, manque d’absorption du secondaire, intervalle de change trop long ou bourgeons proéminents coincés dans les mailles. Prévenir par un secondaire adapté et des changements réguliers ; irriguer avant retrait.
Quelle est la taille standard des tulles gras disponibles ?
Tailles courantes : 5×5, 10×10, 10×20, 20×20 cm ; formats allongés 10×40 cm et rouleaux selon les marques.
Quels sont les effets indésirables possibles du tulle gras ?
Macération des berges, adhérence secondaire, douleur au retrait, hyper-bourgeonnement si occlusion excessive, réactions d’hypersensibilité (excipients/antiseptiques).
Quels sont les noms commerciaux du tulle gras disponibles en France, Suisse et Belgique ?
Exemples : Cuticell Classic® (BSN), Lomatuell H® (Lohmann-Rauscher), Jelonet® (Smith & Nephew), Medi Tulle®, Méditulle® (Euromedis), Adaptic®, Grassolind® ; disponibilités et tailles variables selon pays.
Quel pansement mettre par-dessus le tulle gras ?
Un secondaire absorbant (compresses stériles, hydrofibre/alginate/ superabsorbant selon l’exsudat) et un maintien adapté ; éviter de superposer deux interfaces grasses.
Le tulle gras est-il adapté aux escarres ?
À réserver aux situations superficielles et peu exsudatives ; pour escarres évoluées, privilégier des interfaces/absorptions adaptées.
Quel est le prix moyen du tulle gras et son mode de délivrance ?
Ordre de grandeur : 5 à 15 € la boîte selon taille/marque/conditionnement. Délivrance en pharmacie et circuits professionnels.
Références (sélection)
- NICE. Chronic wounds: advanced wound dressings and antimicrobial dressings. ESMPB2, 2016. Lien – PDF
- Wasiak J et al. Dressings for superficial and partial thickness burns. Cochrane 2013. PubMed
- Genuino GAS et al. Petrolatum vs silver sulfadiazine in superficial partial thickness burns. Burns 2014. PubMed
- Tulle Gras wikipedia
- Allergies : Baume du Pérou (revue 2019/2021), Lanoline (ACDS Allergen of the Year 2023). 1 – 2 – 3 – 4
- NICE CG179 (2014, surveillance 2018). Ulcères de pression : ne pas utiliser de gaze. Lien
- VLU et compression : NICE HTE (2025) & revues 2023/2021. HTE – 2023 – 2021
- Réglementation France (LPP 2025) : Ordre des Pharmaciens, AMELI, Legifrance. 1 – 2 – 3
- Suisse – LiMA/MiGeL : OFSP. FR – DE
- Belgique – INAMI & organismes.

Alginate pansement : mécanismes, indications, mode d’emploi, complications et produits disponibles
Historique
Les pansements à base d’alginate, polymères naturels extraits d’algues brunes (principalement Laminaria), sont utilisés en chirurgie et en cicatrisation depuis les années 1980 après des travaux initiaux (alginate décrit au XIXe siècle, applications médicales standardisées au XXe siècle). Ils se sont imposés comme pansements « gélifiants » pour des plaies exsudatives et hémorragiques.Propriétés et mode d’action
- Composition : alginate de calcium (fibres non tissées) – parfois pur, parfois associé à de la CMC (carboxyméthylcellulose), ou chargé en ions argent. Formes : compresses et mèches (ribbons/packing).
- Gélification & structure M/G : l’« agent gélifiant » (blocs d’acide guluronique [G] et mannuronique [M], appelé aussi maluronique) détermine la consistance du gel : riche en G → gel plus ferme ; riche en M → gel plus souple. En pratique, la proportion G/M influe sur la gélification ressentie au retrait.
- Absorption par capillarité (latérale) : l’alginate absorbe de façon passive par capillarité (différent des hydrofibres de type CMC pure qui ont une absorption verticale limitant la diffusion latérale).
- Drainage élevé : fort pouvoir d’absorption et drainage important → toujours prévoir un pansement secondaire de recueil (idéalement à absorption verticale, p. ex. super‑absorbant) pour stocker les exsudats. Attention : si saturation, l’alginate peut relarguer des exsudats dans la plaie.
- Piégeage bactérien / action antibactérienne : les fibres piègent les germes (effet barrière), activité antibactérienne large (incluant Pseudomonas aeruginosa), renforcée si argent. Cliniquement, une exsudation vert/bleu‑vert (pyoverdine/pyocyanine) peut teinter le pansement et suggérer la présence de Pseudomonas.
- Pouvoir détersif : la gélification favorise le débridement autolytique.
- Hémostase : échange d’ions (Na⁺ des exsudats ↔ Ca²⁺ des fibres) → libération locale de Ca²⁺ et arrêt du saignement (effet hémostatique utilisé y compris en chirurgie).
Indications
- Plaies exsudatives à fortement exsudatives (ulcères veineux/artériels/mixtes, escarres, plaies tumorales, plaies post‑opératoires et sites donneurs de greffe).
- Plaies hémorragiques (effet hémostatique) et plaies infectées (préférer les versions à argent en cas de charge microbienne élevée/risque d’infection).
- Plaies fibrino‑nécrotiques (effet détersif/gélification utile).
- Plaies cavitaires ou tunnelisées (formes mèches particulièrement adaptées).
Contre‑indications (et précautions)
- Plaies sèches : contre‑indication (risque d’adhérence/dessèchement).
- Hypersensibilité/intolérance : rare ; envisager allergie à la CMC si alginate associé à CMC.
- Hyperbourgeonnement : possibles cas avec des fibres CMC associées (observations cliniques) ; réduire l’humidité, privilégier alternance de pansement si besoin ou un alginate de calcium pur.
- Ne pas utiliser pour contrôler une hémorragie massive (préférer dispositifs d’hémostase dédiés).
Utilisation pratique (pas à pas)
Fréquence : réfection quotidienne en contexte très exsudatif/infecté ; sinon adapter à l’exsudat et à l’état du pansement secondaire.- Préparation : nettoyer/irriguer au sérum physiologique (NaCl 0,9 %).
- Dimensionnement : sur plaie superficielle, découper à la taille exacte (éventuelle superposition) pour éviter la macération des berges (capillarité latérale).
- Cavités larges : poser en accordéon.
- Plaies tunnelisées : mécher sans tasser, laisser un excédent visible pour le retrait ; si orifice étroit, humidifier légèrement l’extrémité de la mèche et introduire délicatement à la pince.
- Plaies peu exsudatives (si alginate indispensable) : humidifier très légèrement l’alginate avec NaCl 0,9 % puis couvrir d’un semi‑occlusif (hydrocellulaire/hydrocolloïde).
- Pansement secondaire : privilégier super‑absorbant (absorption verticale) ou hydrocellulaire.
- Retrait : atraumatique. Si adhérence : saturer au NaCl 0,9 %, décoller lentement et délicatement.
- Découpe : l’alginate est découpable (stérilité à préserver).
Complications et conduite à tenir
- Assèchement/douleur au retrait ± saignement (plaie peu exsudative) → prévenir par humidification préalable et/ou changement de stratégie de pansement.
- Macération périlésionnelle (application trop large en superficiel) → recouper à la taille, protéger la peau, utiliser un secondaire vertical.
- Relargage d’exsudats (saturation, absence de recueil) → renforcer le secondaire, augmenter fréquence de réfection.
- Résidus de fibres (surtout si assoc. CMC ou tissages fragiles) → inspection systématique au retrait ; irriguer pour éliminer tout résidu (risque de colonisation/infection).
- Hyperbourgeonnement sous pansement très occlusif ou riches en CMC → espacer les changements, alterner avec pansement moins occlusif, contrôler l’humidité.
- Durée d’utilisation : pas de durée limite spécifique aux alginates ; adapter la fréquence et la poursuite selon l’exsudat (généralement quotidienne, sauf plaies peu exsudatives).
Produits disponibles & tailles (sélection, France / Belgique / Suisse)
NB : Tailles indicatives ; vérifier la dispo locale et remboursement. Tous nécessitent un pansement secondaire.France
- Algostéril® (Brothier) – compresses et mèches hémostatiques ; formats courants : compresse 10×10 cm, 10×20 cm ; mèche plate 5×40 cm, mèche ronde 30 cm.
- Kaltostat® (ConvaTec) – compresses 5×5 cm, 7,5×12 cm, 10×20 cm ; mèche (usage hospitalier).
- Suprasorb® A / A+Ag (Lohmann & Rauscher) – compresses 10×10 cm, 10×20 cm ; versions Ag disponibles.
- Melgisorb® / Melgisorb® Ag (Mölnlycke) – compresses 5×5 cm, 10×10 cm ; Ag pour plaies à risque infectieux.
- UrgoSorb® / UrgoSorb® Silver (Urgo) – compresse 5×10 cm, 10×12 cm, 10×20 cm ; mèche 5×30 cm ; version Ag (rope 2,5×30 cm).
Belgique
- Biatain® Alginate / Alginate Ag (Coloplast) – compresses 5×5 cm, 10×10 cm ; mèche 3×44 cm (Ag).
- Suprasorb® A ± Ag (L&R Belgique) – compresses 5×5 cm, 10×10 cm, 10×20 cm.
- Melgisorb® Ag (Mölnlycke) – compresses 5×5 cm.
Suisse
- Kaltostat® (ConvaTec) – compresses 5×5 cm, 7,5×12 cm, 10×20 cm ; mèches/tampons pour cavités.
- Melgisorb® Plus / Melgisorb® Ag (Mölnlycke) – compresses 5×5 cm, 10×10 cm.
- Biatain® Alginate / Alginate Ag (Coloplast) – disponibilité locale, formats équivalents (compresse 10×10 cm ; mèches longues).
« Alginate-pansement » : points différenciants
- Capillarité latérale vs verticale des hydrofibres (CMCs).
- Hémostase par échange Na⁺/Ca²⁺.
- Cavités/tunnels : mèches non tassées, dépassement visible.
- Toujours un secondaire à absorption verticale pour éviter macération/relargage.

FAQ clinique – Alginate
1. Qu’est‑ce qu’un pansement alginate et comment fonctionne‑t‑il ?
Pansement gélifiant à base d’alginate de calcium (fibres issues d’algues brunes). Absorption par capillarité (latérale) avec fort pouvoir d’absorption et drainage élevé ; gélification au contact des exsudats, piégeage bactérien (effet barrière), détersion favorisée. Hémostase par échange Na⁺/Ca²⁺. Toujours associer un pansement secondaire à absorption verticale.2. Différence entre pansement alginate et hydrofibre/hydrocolloïde ?
Alginate : absorption passive par capillarité (latérale), gélifiant, hémostatique ; nécessite secondaire vertical. Hydrofibre (CMC) : absorption verticale limitant la diffusion latérale. Hydrocellulaire ou hydrocolloïde : semi‑occlusif utilisé comme couvercle/secondaire notamment si plaie peu exsudative (après humidification légère de l’alginate si celui‑ci est indispensable).3. Pour quels types de plaies ?
Exsudatives à fortement exsudatives, hémorragiques, infectées (versions argent), fibrino‑nécrotiques, cavitaires/tunnelisées (formes mèches).4. Indication en cas de plaie infectée ou nécrotique ?
Oui : infectée (préférer alginate‑argent selon charge microbienne/risque) et fibrino‑nécrotique (détersif/gélification).5. Utilisation sur plaie peu exsudative ?
À éviter (risque d’adhérence/dessèchement). Si indispensable : humidifier très légèrement au NaCl 0,9 % puis couvrir d’un semi‑occlusif (hydrocellulaire/hydrocolloïde).6. Contre‑indications ?
Plaies sèches. Hypersensibilité/intolérance (rare) ; allergie à la CMC si association. Hyperbourgeonnement possible avec fibres CMC associées. Non adapté à l’hémorragie massive.7. Risques/effets secondaires d’un mauvais usage ?
Assèchement/douleur ± saignement, macération périlésionnelle, relargage d’exsudats si saturation/absence de recueil (risque colonisation/infection), résidus de fibres (surtout si assoc. CMC), hyperbourgeonnement.8. Comment appliquer correctement ?
Nettoyer/irriguer → découper exact en superficiel → accordéon en cavité → mécher sans tasser en tunnel (laisser dépassement, humidifier l’extrémité si orifice étroit) → secondaire super‑absorbant (ou hydrocellulaire) → réévaluer exsudat.9. Peut‑on découper un alginate ?
Oui, découpable (préserver la stérilité).10. Faut‑il humidifier avant application ?
Non systématique. Oui, légèrement si plaie peu exsudative ou pour faciliter l’introduction d’une mèche à orifice étroit.11. Quel pansement secondaire associer ?
Super‑absorbant (absorption verticale) en priorité ; hydrocellulaire possible.12. Fréquence de changement ?
Quotidienne en contexte très exsudatif/infecté ; ensuite adapter à l’exsudat et à l’état du secondaire.13. Retrait sans douleur/sans résidus ?
Saturer au NaCl 0,9 % si adhérence, retirer lentement ; inspection systématique et irrigation pour éliminer d’éventuels résidus.14. Que faire s’il adhère ?
Saturer au NaCl 0,9 %, détacher doucement.15. Tailles et présentations disponibles ?
Compresses (ex. 5×5, 7,5×12, 10×10, 10×20 cm selon marques) et mèches/rubans (ex. 2,5–5 cm de large, longueurs ~30–44 cm selon marques). Les formats précis varient par pays et marque (voir liste produits FR/BE/CH).16. Alginate imprégné (argent, miel) ? Dans quels cas ?
A privilégier en cas de charge microbienne élevée/risque d’infection.17. Principales marques (France/Belgique/Suisse) ?
France : Algostéril® (Brothier), Kaltostat® (ConvaTec), Suprasorb® A/A+Ag (Lohmann & Rauscher), Melgisorb®/Melgisorb® Ag (Mölnlycke), UrgoSorb®/UrgoSorb® Silver (Urgo). Belgique : Biatain® Alginate/Alginate Ag (Coloplast), Suprasorb® A ± Ag (L&R), Melgisorb® Ag (Mölnlycke). Suisse : Kaltostat® (ConvaTec), Melgisorb® Plus/Ag (Mölnlycke), Biatain® Alginate/Alginate Ag (Coloplast).18. Comment l’alginate favorise cicatrisation et hémostase ?
Gestion des exsudats par gélification/capillarité, détersion autolytique, piégeage des germes ; hémostase locale par libération de Ca²⁺ (échange Na⁺/Ca²⁺).19. Avantages vs autres absorbants ?
Fort pouvoir d’absorption, drainage élevé, hémostase et adaptation aux cavités/tunnels (formes mèches). Point clé : nécessite secondaire vertical pour limiter macération/relargage.20. Capacité d’absorption ?
Qualifiée de forte.21. Alginate vs hydrofibre : choix pour plaie cavitaire ?
L’alginate en mèche pour cavités/tunnels (mécher sans tasser, dépassement visible) est une bonne indications. Les hydrofibres sont une bonne alternative.22. Alginate vs mousse : efficacité pour plaie très exsudative ?
Les mousses hydrocellulaires ne sont pas indiquées pour une plaie très exsudative. Il est recommandé d’utiliser l’alginate en pansement primaire associé à un secondaire super‑absorbant (absorption verticale) ; un hydrocellulaire peut également être utilisé en secondaire. Les alternatives sont les pansements hydrofibres ou les pansements superabsorbants, les deux pouvant être associés.Conclusion
L’alginate‑pansement est un outil de première intention pour les plaies exsudatives, hémorragiques ou cavitaires. Son absorption par capillarité impose un secondaire à absorption verticale et une surveillance étroite pour prévenir macération et relargage. Les versions argentées élargissent l’indication aux plaies à risque infectieux (dont Pseudomonas). La sélection du produit (pur vs CMC, ±Ag, compresse vs mèche) et la technique d’application (taille exacte, accordéon, mèche non tassée) conditionnent le résultat. Changer quotidiennement en contexte très exsudatif, adapter ensuite au niveau d’exsudat.Gagnez en efficacité dans vos soins des plaies avec le Cicannuaire !
Cette base de données spécialisée vous aide à choisir rapidement le bon pansement, la crème adaptée ou le dispositif idéal. Conçu par des experts en cicatrisation, il s’adresse aux infirmiers, médecins, podologues et chirurgiens. Recherche par filtres, plans de soins personnalisés, mises à jour régulières… Un outil essentiel pour les professionnels du soin, des plaies chroniques aux plaies aiguës.

Références (2010–2025)
- Aderibigbe BA. Alginate in Wound Dressings. 2018 (revue). PMCID PMC6027439.
- Xie Y, et al. Application of Alginate‑Based Hydrogels in Hemostasis. 2022. PMCID PMC8871293.
- O’Meara S. Cochrane – Alginate dressings for venous leg ulcers. 2015. PMCID PMC7087437.
- WUWHS. Role and composition of wound exudate – Consensus Document. 2019/2020. PDF.
- Raizman R, et al. Rapid diagnosis of P. aeruginosa in wounds. 2021. PMCID PMC7917920.
- Abka‑khajouei R. Marine Drugs. 2022. Article.
- Sorbsan (Aspen). Booklet. 2023. PDF.
- Coloplast. Biatain Alginate / Alginate Ag. Fiches produit. FR‑US ; Ag.
- HAS – CNEDiMTS. Algostéril : mèche et compresse. 15/12/2020. Avis.

Faut-il systématiquement humidifier les pansements à base d’alginate de calcium ?
La question de l’humidification des pansements à base d’alginate de calcium suscite des débats. Ce post explore les avantages et les inconvénients de cette pratique, en mettant en lumière les situations où elle peut être bénéfique, tout en soulignant l’importance de la prise de décision basée sur des preuves plutôt que sur des arguments commerciaux. Découvrez quand et comment l’humidification peut être judicieuse pour optimiser les résultats de cicatrisation.
Personnellement, en dehors de certaines situations particulières, je ne trouve pas nécessaire de le faire.
Les propriétés des alginates de Calcium
Les pansements à base d’alginate de calcium sont connus pour leur capacité d’absorption élevée ainsi que leur propriété détersive.
Leur capacité d’absorption par capillarité de haute qualité leur offre une propriété de drainage exceptionnelle. De plus, lorsqu’ils sont purs, ils présentent également d’excellentes propriétés hémostatiques.
Le débat sur l’humidification
L’humidification d’un pansement à base d’alginate de calcium lorsqu’il est utilisé pour drainer une plaie exsudative, comme une plaie cavitaire, vers un pansement « stockeur » de type super absorbant, n’apporte pas d’avantages significatifs, sauf à réduire son efficacité en tant qu’agent de drainage.
Dans le cas des ulcères veineux et du pied diabétique, cette humidification peut même entraîner une macération indésirable.
Il est vrai que certains représentants commerciaux mettent en avant l’hydratation systématique, arguant que l’échange ionique favorise la cicatrisation, ce qui est exact.
Cependant, il existe une distinction entre humidifier complètement le pansement avec du sérum physiologique et permettre l’échange ionique grâce aux exsudats naturels de la plaie.
Les circonstances où l’humidification est nécessaire
Selon mon expérience, il y a deux situations particulières dans lesquelles l’humidification peut être appropriée :
1. Pour profiter des propriétés hémostatiques de l’alginate de calcium, il peut être nécessaire de saturer le pansement avec du sérum physiologique afin de favoriser l’échange entre les ions sodium et calcium, présents en grande quantité dans le pansement et ayant un fort pouvoir hémostatique.
2. En cas de plaies peu exsudatives, où d’autres alternatives ne sont pas envisageables, quelques gouttes de sérum physiologique peuvent être utilisées pour humidifier le pansement.
Conclusion
En matière de cicatrisation, il est essentiel d’être efficace, de prendre du recul et de ne pas accorder une confiance aveugle aux discours commerciaux, même si l’on entretient de bonnes relations avec les représentants.
Quel est votre avis à ce sujet ?

